Wie kann ich hier den pH- Wert berechnen?
Hallo, ich schreibe Morgen eine Chemie Klausur und bräuchte dringend Hilfe bei Aufgabe 5 und 6. Zu 6.: woher weiß ich was der pH-Wert von den 3ml Kalilauge ist? Ich bin sehr verwirrt. Schonmal danke

1 Antwort
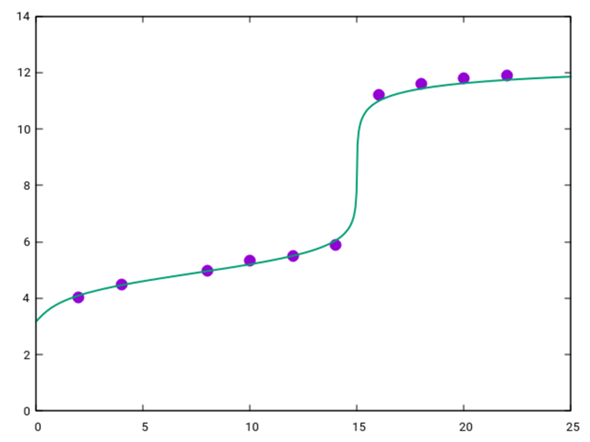
Deine Titrationskurve sieht also ungefähr so aus:
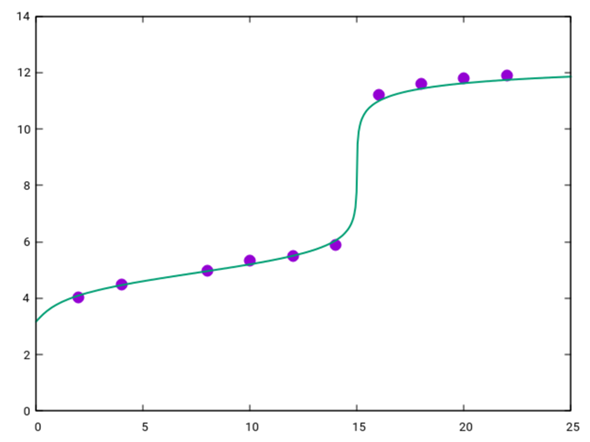
Die grüne Kurve, die ich in Deine Punkte gezeichnet habe, ist die berechnete Titrationskurve für pKₐ=4.9 und c(CH₃CH₂COOH)=0.0375 mol/l.
- Der Äquivalenzpunkt liegt bei 15 ml, dabei wurden n=cV=0.375 mmol KOH verbraucht. Also enthielten die V=10 ml Propionsäure ebensoviel, also hatte sie eine Konzentration c=n/V=0.0375 mol/l.
- Der pKₐ-Wert ist als pH beim halben Verbrauch, also bei 7.5 ml, abzulesen.
- Der pH am Anfang der Titration (V=0) ist einfach der einer 0.0375 mol/l Propionsäure, das sind pH=½(pKₐ−lg(c))=3.16
Der pH-Sprung tritt grob im Bereich von 7 bis 10 ein; man braucht also einen Indikator, der in diesem Intervall umschlägt. In Deiner Liste ist Phenolphthalein am besten geeignet.
Nach Zugabe von 6 ml KOH hat man zusätzlich zu den 0.375 mmol Propionsäure noch n=cV=0.15 mmol KOH in der Suppe; die reagieren zu 0.15 mmol Kaliumpropionat, und 0.225 mmol Propionsäure bleiben übrig.
CH₃CH₂COOH + KOH ⟶ CH₃CH₂CO₂¯K⁺ + H₂O
Die beiden Substanzen bilden nun einen Puffer, und der pH ist
pH = pKₐ + lg(Kaliumproprionat/Propionsäure) = 4.72
Wenn weitere 3 ml KOH zugesetzt werden, steigt der pH auf 5.08 (selber Rechenweg). Die Volumina sind dabei nicht relevant, weil Puffer verdünnungsstabil sind, ihren pH also unabhängig von der Verdünnung in großem Rahmen konstant halten.
Pro-Tip: Der Pufferbereich der Kurve (grob von 2 ml bis 13 ml Verbrauch) läßt sich kompakt mit der Formel pH = pKₐ + lg [ V/(Vₑ−V) ] beschreiben, wobei Vₑ=15 ml der Verbrauch am Äquivalenzpunkt ist.
Würde man 3 ml KOH c=0.025 mol/l mit 16 ml Wasser verdünnen, dann erhielte man eine KOH der Konzentration 0.025⋅3⁄19=0.00395 mol/l, und der pH wäre pH=14+lg(c)=11.6.