Wie findet man heraus ob es eine Elektronenpaarbindung oder eine ionenbindung ist?
Hallo ich bin in der 8. Klasse und weiß nur wie man dass mit zwei Stoffen herausfindet (halt mit der Elektronegativitätsdifferenz) aber dass funktioniert doch nicht mit 4 stoffen oder?
2 Antworten
Du hast recht, die Elektronegativitätsdifferenz (EN-Differenz) ist der Schlüssel, um zwischen Elektronenpaarbindung (kovalente Bindung) und Ionenbindung zu unterscheiden, aber sie wird bei Molekülen mit mehr als zwei Atomen etwas komplexer. Lass uns das klären:
Schritt 1: Bei zwei Stoffen
Wenn du nur zwei Elemente betrachtest, schaust du auf die EN-Werte:
EN-Differenz ≤ 0,4: Unpolare kovalente Bindung (z. B. H₂, Cl₂).
EN-Differenz zwischen 0,5 und 1,7: Polare kovalente Bindung (z. B. HCl).
EN-Differenz > 1,7: Ionenbindung (z. B. NaCl, MgO).
---
Schritt 2: Bei mehr als zwei Stoffen
Wenn ein Molekül aus vier Stoffen oder mehr besteht (z. B. CH₄, NH₃), gibt es keine einzige EN-Differenz für das ganze Molekül. Hier gehst du folgendermaßen vor:
1. Vergleiche die Bindungen zwischen jedem Atompaar:
Bestimme die EN-Differenz für jede einzelne Bindung.
Beispiel: In CH₄:
Kohlenstoff (C) hat eine EN von 2,5.
Wasserstoff (H) hat eine EN von 2,1.
EN-Differenz: 2,5 - 2,1 = 0,4 → Unpolare kovalente Bindungen.
2. Gesamte Molekülstruktur betrachten:
Manche Moleküle haben polare Bindungen, aber die Polarität gleicht sich geometrisch aus, z. B. in CO₂ (lineare Struktur, Ladungsschwerpunkte heben sich auf). Andere Moleküle, wie NH₃ (pyramidal), bleiben polar.
3. Metall-Nichtmetall-Regel:
Bindungen zwischen einem Metall und einem Nichtmetall sind oft Ionenbindungen (z. B. NaCl, MgBr₂).
Bindungen zwischen Nichtmetallen sind meist kovalent (z. B. H₂O, CH₄).
---
Zusammenfassung für dich:
Für jede einzelne Bindung nutzt du die EN-Differenz, um zu prüfen, ob sie ionisch oder kovalent ist.
Bei mehratomigen Molekülen schaust du auf die Struktur und die Ladungsverteilung im Molekül.
Komplizierte Moleküle wie z. B. Salze (MgCl₂) sind ionisch, während Moleküle wie Zucker kovalente Bindungen haben, weil sie nur aus Nichtmetallen bestehen.
Interessant...
Wie sind denn deiner Meinung nach die Bindungsverhältnisse beim Fluorwasserstoff (HF)?
Nach deiner Erklärung „zwei Stoffe” (was immer du damit meinst)?! Also schauen wir uns nur die EN-Differenz an, was man nach deinem ersten Schritt tun soll.
Die EN-Differenz beträgt 3,98 – 2,2 = 1,78
Aha! Also eine Ionenbindung, nicht wahr?
Oder werfen wir einen Blick auf Berylliumsulfid (BeS): wieder „zwei Stoffe” nach deiner Erklärung. Na, dann der Blick auf die EN-Differenz:
2,58 – 1,57 = 1,01
Wow, demnach eine polare Atombindung...
Komisch. Fluorwasserstoff ist unter normalen Bedingungen (22°C und 1013,25 hPa) ein Gas mit HF-Molekülen (also keine kristalline Substanz, wie man es doch von einer Ionenverbindung mit Ionenbindungen erwarten würde)!?
Berylliumsulfid ist dagegen unter normalen Bedingungen ein kristalliner Feststoff, wie er für Salze (Ionenverbindungen mit Ionenbindungen) typisch ist.
Aaah, ich spüre schon deinen Einspruch... In beiden Fällen gilt die 3., die Metall-Nichtmetall-Regel, was?
Okay. Dann werfen wir abschließend doch noch einen Blick auf Ammoniumiodid (NH4I).
Nach deiner Erklärung „mehr als zwei Stoffe”. Also müssen wir alle Bindungen einzeln betrachten:
H–N-Bindung: EN-Differenz 0,84 → polare Atombindung
N und I: EN-Differenz 0,38 → unpolare Atombindung
oder
gibt es hier etwa eine H–I-Bindung? - Dann wäre die EN-Differenz 0,46 → also eine noch unpolare, knapp an der Grenze zur polaren Atombindung
Weit und breit keine EN-Differenz, die zur Ionenbindung tendiert.
Und alles Nichtmetalle. Kein einziges Metall enthalten...
Und doch ist das eine Ionenverbindung (ein Salz) mit Ionenbindungen.
Irgend etwas stimmt mit deiner Erklärung nicht!
Und was sind „komplizierte Moleküle” im Zusammenhang mit Salzen? Was ist dann Diamant? Oder warum bildet Zucker auch Kristalle, wenn der doch nur aus Molekülen mit Atombindungen besteht?
Mit deiner Erklärung bleibt das alles mysteriös... Oder kannst du es mir noch nachträglich erläutern?
Nichts für ungut...
LG von der Waterkant
Erstens: Wir reden hier von Atomen und Molekülen, nicht von Stoffen. Wenn dir der Unterschied nicht bewusst ist, solltest du das dringend nachlernen!
Und dann betrifft eine Atombindung immer nur zwei Atome. Das Atom am einen Ende und das Atom am anderen Ende. Und wenn du die Polarität dieser Atombindung betrachtest, vergleichst du die EN-Werte genau dieser beiden Atome.
Auch bei größeren Molekülen mit mehreren Atomen ist eine Atombindung immer zwischen zwei Atomen. Das Molekül hat dann halt mehrere Atombindungen. Die man separat betrachten muss, also jede dieser Atombindungen hat ihre eigene Polarität.
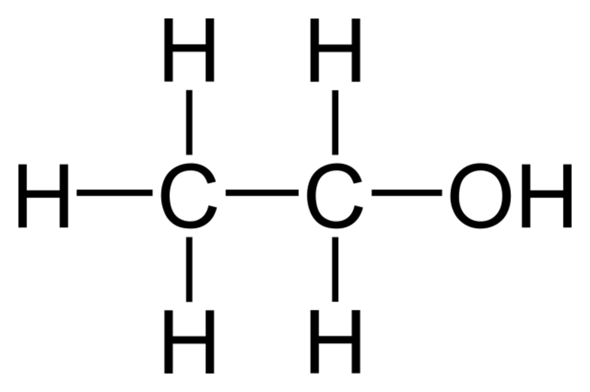
Als Beispiel: Ethanol.

Dieses Molekül besitzt:
- 1 C-C Bindung,
- 5 C-H-Bindungen,
- 1 C-O-Bindung und
- 1 O-H-Bindung
Die allesamt unterschiedliche EN-Differenzen haben und damit unterschiedlich stark polar sind, von der unpolaren C-C-Bindung hin zur stark polaren O-H-Bindung.
In der Gesamtbetrachtung des Moleküls hast du einen polaren Teil (die OH-Gruppe) und einen unpolaren Teil (C2H5). Das heißt, das Molekül hat sowohl einen polaren, als auch einen unpolaren Charakter. Beim Thema "gleiches mischt sich mit gleichem" ist es sowohl in polaren, als auch in unpolaren Lösemitteln löslich.
...bitte was?
Irgendwie habe ich den Eindruck, dass du die Frage einfach in ChatGPT eingegeben und die Antwort hier reinkopiert hast, ohne sie überhaupt zu lesen...