Warum wird Zinn(II)-chlorid als ionisch betrachtet, sollte es nicht besser als Zinndichlorid bezeichnet werden?
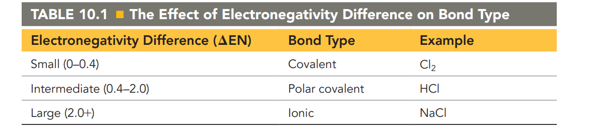
Ich habe gelernt, dass Bindungen als ionisch gelten, sobald der Ionencharakter etwa 50% beträgt, was bei einer Elektronegativitätsdifferenz ab 1,7 (oder ab 2 nach der untenstehenden Tabelle) der Fall ist.
In Zinn(II)-chlorid haben Sn und Cl jedoch nur einen Unterschied von 1,2, so dass ich die Benennung von Zinn(II) für Sn2+ und Chlorid für Cl- nicht verstehe, da das ja aussagt es seien Ionen.
(Chemistry: A Molecular Approach, Nivaldo J. Tro)
Ausgehend von dieser Einteilung müsste Zinn(II)-chlorid polar kovalent und nicht ionisch sein. Warum wird es dann nicht als Zinndichlorid bezeichnet?
1 Antwort
Ganz einfach. Diese Einteilung mit "Ionenbindung ab EN > 1,7" ist schlichtweg nicht immer zutreffend. Das ist so eine Daumenregel und davon gibt es logischerweise auch Ausnahmen.
Umgekehrtes Beispiel zu Zinnchlorid ist HF. Das hat eine EN Differenz von 1,8 (oder 2 je nach Einteilungssystem) hat aber eine kovalente Bindung (gut, der ionische Anteil liegt bei 47%, aber trotzdem werden die Elektronen noch geteilt und liegen nicht vollständig beim F).
Für die korrekte Einteilung bräuchte es eine wesentlich kompliziertere Regel, aber da die einfache für so gut wie alle Verbindungen zutreffend ist, benutzt man die nach wie vor. Man kann den tatsächlichen kovalenten/ionischen Charakter einer Bindung aber verlässlich berechnen, nur ist das eben sehr aufwändig.