Warum bilden Kalium, Rubidium und Cäsium Hyperoxide?
Hallo, ich stelle mir gerade die Frage, warum ausgerechnet Kalium, Rubidium und Cäsium Hyperoxide bilden (vorrangig! Also Oxide, die das O-O minus Ion enthalten). Ich meine: interessant ist es schon, wenn man betrachtet, dass Lithium Oxide bildet, Natrium Peroxide (wenn ich das MO-Schema von H2O2 richtig habe, dann dürfte das im Gegensatz zu O2 nicht paramagnetisch sein, weshalb auch die Bindungsordnung nur noch 1 beträgt, wobei wir auch ein Sauerstoff streng genommen diradikalische Strukturen haben). Aber was ist die plausible Erklärung hierfür?
3 Antworten

Letztlich geht es da um energetische Fragen. Dazu muss man erst mal mit Vorurteilen oder Ungenauigkeiten aufräumen:
- Auch Alkalimetalle wollen ihr Außenelektron keineswegs loswerden. Im Gegenteil, die Ionisierung erfordert Energie, in diesem Fall nur recht wenig.
- Die Nichtmetalle in der Fluor-Ecke haben zwar eine negative Elektronenaffinität, d.h. bei der Bildung von eines Fluoridions aus einem Fluoratom wird Energie frei. Aber das gilt nur für das erste aufgenommene Elektron. Die Bildung des Oxidions kostet Energie.
Dazu kommen noch die Sublimationsenergie des Metalls und die Dissoziationsenergie des Sauerstoffmoleküls.
Diese 4 (alle postiven) Beiträge müssen/müssten durch die Gitterenergie kompensiert werden, um die Gesamtreaktion zu ermöglichen.
Und da kommt die unterschiedliche Größe der Alkalimetallionen ins Spiel, denn die ist ja proportional zu LadungKation*LadungAnion/r²
Die Ionen von K, Rb und Cs sind schlicht zu groß, um eine hohe Gitterenergie zu ermöglichen.
Noch was zum Paramagnetismus:
- Das Peroxidion ist isoelektronisch zum Fluormolekül, mit Einfachbindung (bzw. 2 doppelt besetzen antibindenden Pi-Orbitalen), also nicht paramagnetisch.
- Hyperoxid hat eine Eineinhalbfachbindung bzw. ein doppelt und ein einfach besetztes antibindenes Pi-Orbital, ist also ein einfaches Radikal.

Wikipedia sagt folgendes:
Hyperoxide entstehen bei der Verbrennung der Alkalimetalle Kalium, Rubidium und Caesium in Gegenwart von Sauerstoff. Natrium verbrennt dagegen hauptsächlich zum Peroxid. Lithium – auch bei großem Sauerstoffüberschuss – überwiegend zum Oxid. Der Grund für das unterschiedliche Verhalten liegt im Anwachsen des Ionenradiusmit steigender Periode des Alkalimetalls, der Zunahme der Weichheit der Kationen und im Gewinn an Gitterenergie: während das kleine, harte Lithium-Kation das ebenfalls kleine und harte Oxid-Anion als Bindungspartner im Ionenkristall bevorzugt, tritt ab Kalium, aber insbesondere beim Rubidium bzw. Caesium das große, wesentlich weichere Hyperoxid-Anion an dessen Stelle.

Hyperoxide sind noch von einer Handvoll anderer Metalle bekannt — Al(O₂)₃ bildet sich bei der Reaktion von Al-Atomen (Gas) mit O₂ bei tiefen Temperature (Matrix), dann gibt es noch ein TlO₂ ( = Tl⁺O₂⁻), erhältlich durch Elektrolyse von Tl₂SO₄ mit Pt-Anode, LiO₂ ist auch so ein Matrix-Vogel und vermutlich das per Masse sauerstoffreichste Metalloxid überhaupt, und NaO₂ ist dagegen verhältnismäßiig stabil und bildet sich beim Verbrennen von Natrium mit 150 bar Sauerstoff (das Experiment würde ich gerne mal sehen, aber aus naheliegenden Gründen führt man die Reaktion nicht so direkt aus, sondern läßt lieber Na₂O₂ bei 450°C mit 150 bar Sauerstoff reagieren). Zuletzt ist die ganze Reihe von Mg(O₂)₂ bis Ba(O₂)₂ bekannt.
Außerdem gibt es noch Verbindungen wie FAl(O₂)₂ und Hyperoxo-Komplexe, bizarrerweise ausgerechnet mit dem oxidationsempfidlichen Cu⁺, da sind nämlich η¹-Komplexe LCuO₂ mit dreizähnigen Liganden L bekannt; beim Cobalt kennt man sowohl η¹ als auch η²-Hyperoxokomplexe. Hyperoxide bilden sich auch im Körper, und wir haben ein Enzym (Hyperoxid-Dismutase), das das Zeug abbaut. Bei zu hohem O₂-Druck wird das Enzym überlastet, und deshalb ist Sauerstoff ab 0.6 bar Druck giftig.
Nach all diesen netten Zitaten aus der Literatur muß ich gestehen, daß ich Deine Frage, welche Elemente und warum Hyperoxide bilden, auch nicht wirklich beantworten kann. Es fällt aber auf, daß Hyperoxide im wesentlichen eine Spezalität der s-Metalle sind, die ja gleichzeitig auch die elektropositivsten Metalle sind. Tl(I) können wir als „s-Metall ehrenhalber“ bezeichnen, und Al(O₂)₃ ist eine beunruhigende Irregularität. Für diese Erklärung spricht auch, daß die Stabilitäten mit der Elektropositivität zunehmen. Dazu kommt, daß große, weiche Kationen eine Tendenz haben, exotische Anionen zu stabilisieren.
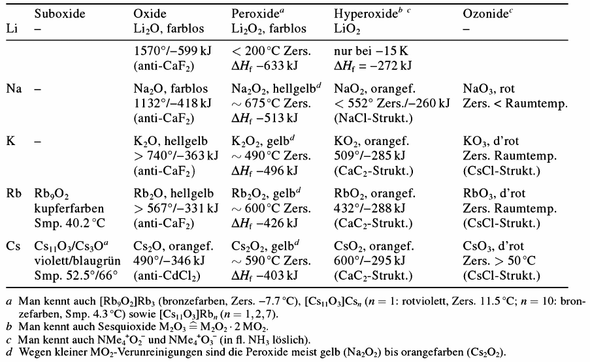
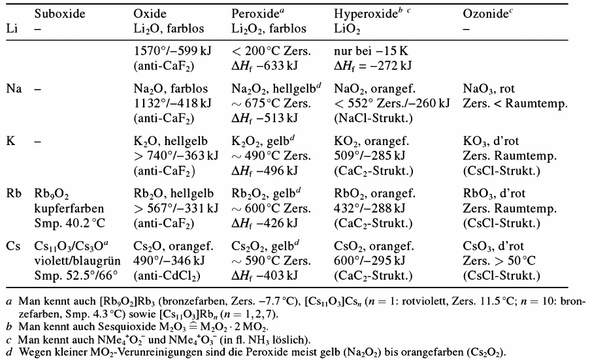
Für Liebhaber von Alkalimetalloxiden gibt es noch eine kleine Bonustabelle