Tartrazin: Mesomerie?
Hallo Leute!
Ich beschäftige mich zurzeit mit der Mesomerie von Tartrazin. Und habe eine Gtenzformel entwickelt. Nun bin ich sehr unsicher, ob dies chemisch gesehen Sinn macht. Deswegen wollte ich mal hier nachfragen, ob mir da jemand eventuell verraten könnte, ob diese Grenzformel so korrekt sein kann.
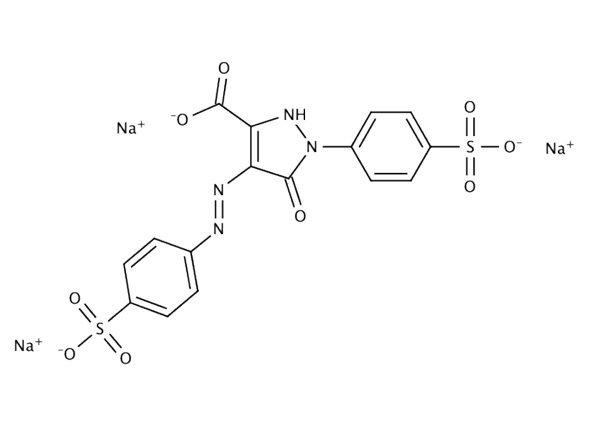
Meine Grenzformel:
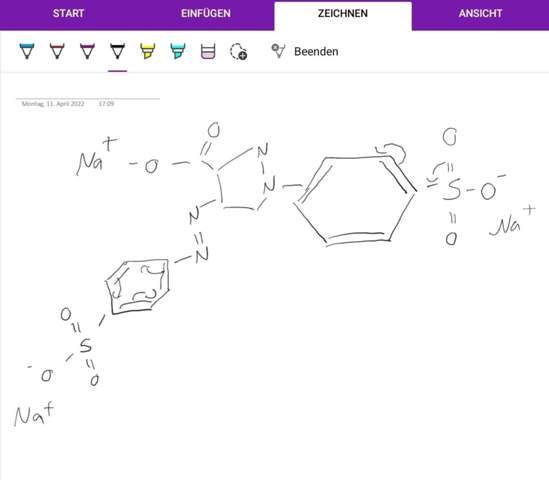
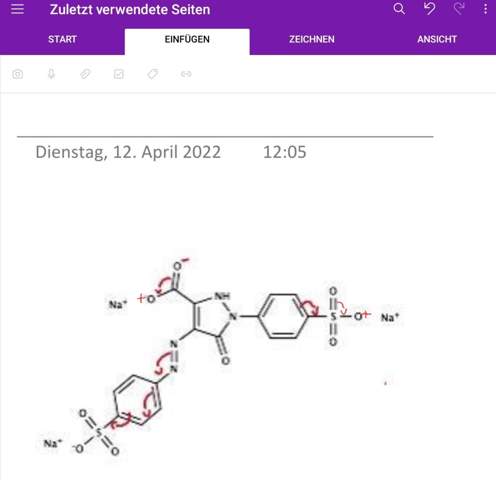
Hab versucht mit euren Anregungen das ganze zu korrigieren. Ist das nun richtig? Bei den Ladungen bin ich mir jedoch unsicher, ob diese so richtig sind.
3 Antworten

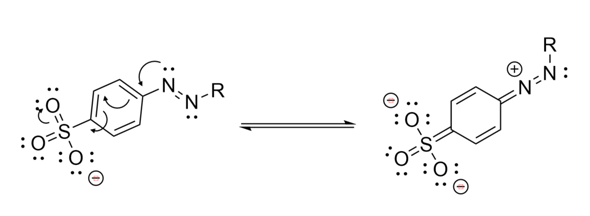
Hi, nachdem ich mir jetzt extra die Mühe gemacht hab eine Strukturformel zu zeichnen, aber deine Frage von vorhin wieder verschwunden ist (warum auch immer), stell ich das jetzt hier rein.
Anmerkung zum Thema Mesomerie: Du kannst nicht einfach an irgendwelchen Bindungen anfangen und sie verschieben. Du musst immer noch die Anzahl der Bindungen der Atome erhalten bzw. ihre Edelgaskonfiguration, wenn man so will. Du kannst also die Stickstoffdoppelbindung nicht einfach wegklappen ohne den Ns etwas zurückzugeben, sonst hätten sie ja auf einmal nur zwei Bindungen (und weniger Elektronen) und das wollen sie ja bekanntermaßen nicht. Außerdem musst du die Ladungen beachten.
Und du musst außer den Elektronenpfeilen auch noch die resultierende Struktur dazu zeichnen. Dazu mal ein Teilausschnitt von deinem Molekül in einer möglichen mesomeren Grenzstruktur:
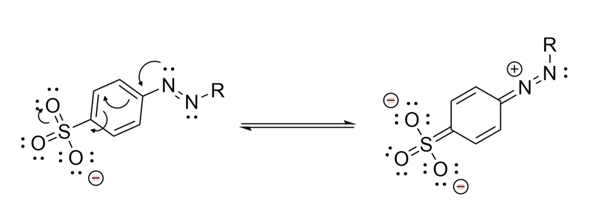

Oh vielen Dank!
Das ist aber sehr lieb von dir und hat mir sehr geholfen. Danke :)

In deiner Grenzformel fehlt eine Doppelbindung im Pyrazolring und die Ketogruppe an selbigem. Außerdem ist die Grenzstruktur, so wie sie da ist unvollständig.
Abgesehen davon hat die Sulfongruppe einen -M-Effekt, wird also dem Ring Elektronen entziehen und ihm keine geben, wie in deiner Formel. Allgemein hast du da sehr viele elektronenziehende Gruppen (die beiden SO3-, die COOH- und die Ketogruppe; und die Phenylringe im Prinzip auch). Du brauchst also etwas, was dir Elektronen ins System schiebt. Und das einzige in der Verbindung, das das kann, sind die Stickstoffatome mit ihren freien Elektronenpaaren.


Das passiert sowieso, weil die Verbindung tautomerisiert. Das H von der OH-Gruppe wandert zum Stickstoff der Azo-Gruppe. Was dann zu einer Keto- und einer Hydrazogruppe führt. Sieht man hier https://de.wikipedia.org/wiki/Tartrazin im Abschnitt Geschichte die unterste Formel.

Jetzt verstehe ich das viel besser! Vielen Dank!

Aber würde diese Formel in dem Artikel auch als Mesomerie gelten?

Eher nicht. Tautomerie ist eine Form der Isomerie, nicht der Mesomerie


Dazu kommt, dass ein aromatisches System nur ungern seine aromatizität aufgibt. Das wäre energetisch ungünstig

Ich habe gleich eine Klausur in advanced organic chemistry daher nur eine kurze Antwort: nein, dein Ansatz ist falsch. Überleg mal, was du mit den negativen Ladungen machen könntest. Zudem hast du einenge Wasserstoffatome und Bindungen unterschlagen

Danke für deine Hinweise! Und viel Glück und Erfolg bei deiner Klausur!



Danke, Klausur vorbei. War nicht mein Lieblingsthema. "Stereochemistry in cyclic systems"

Kann ein trockenes Thema sein, aber da muss man in der OC durch, vor allem in der Biochemie. Dann drück ich dir die Daumen für gute Ergebnisse.

Danke sehr - der Professor hier in den USA den wir haben ist eigentlich sehr gut, nur ich habe erblich bedingt Probleme mit dem räumlichen Sehen, das macht die Sache nicht einfacher.
Könnte ich theoretisch die Doppelbimdung zwischen den zwei Stickstoffatomen auflösen?