Reaktionsgleichung bei der Titration von Apfelsäure?
Hallo,
die Reaktionsgleichung von Apfelsäure bzw. 2-Hydroxybutandisäure ist gesucht, wenn diese durch Titration neutralisiert wird.Sie hatdie beiden Säurekonstanten pka1 = 3,46 und pka2 = 5,1. Die Struktur von der Säure ist mir bekannt. Allerdings frage ich mich, muss ich da jetzt auch das Zwitterion aufschreiben?
2 Antworten
Nein, das ist per Definition kein Zwitterion, wie sie beispielsweise bei den Aminosäuren vorkommen. Es handelt sich hier um eine zweiprotonige Säure, bei der jede Carboxylfunktion ein Aliquot Base zur Neutralisation verbraucht, unabhängig vom pKa-Wert.
Am Ende muss ja ein zweifach negativ geladenes Säurerestion entstehen oder?
Indianchinacook hat die beiden Neutralisationsgleichungen ausführlich in seiner Antwort beschrieben. Dem ist nichts hinzuzufügen.
Äpfelsäure ist eine Hydroxybutandisäure HOOC–CH₂–CH(OH)–COOH. Die beiden COOH-Gruppen sind sauer, und werden beim Umsatz mit Base deprotoniert:
HOOC–CH₂–CH(OH)–COOH + OH¯ ⟶ H₂O + HOOC–CH₂–CH(OH)–CO₂¯
HOOC–CH₂–CH(OH)–CO₂¯ + OH¯ ⟶ H₂O + ¯O₂C–CH₂–CH(OH)–CO₂¯
Weil das Blöd™ zu schreiben ist, kann man sich natürlich auch eine abgekürzte Schreibweise ausdenken und z.B. H₂Mal, HMal¯ und Mal²¯ für die Säure, das Monoanion und das Dianion schreiben. Zwitterionen gibt es bei dieser Säure nicht.

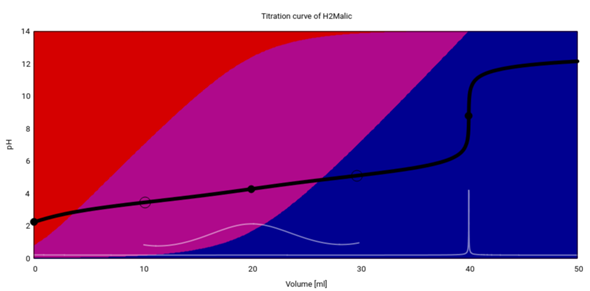
Diese Graphik zeigt die Titration von 20 ml 0.1 mol/l Äpfelsäure mit 0.1 mol/l NaOH. Die schwarze Kurve ist die Titrationskurve, Äquivalenzpunkte (n(OH)=k⋅n₀(H₂Mal) mit k∈ℕ₀) sind als Vollkreis und Pufferpunkte (pH=pKₐ) als Kreisringe eingezeichnet. Die Hintergrundfarben (rot, purpur, blau) stehen für die drei Spezies (H₂Mal, HMal¯, Mal²¯), und außerdem gibt es noch die erste Ableitung der Titrationskurve in Weiß.
Du siehst, daß es keinen Punkt im Diagramm gibt, in dem alle Äpfelsäure als HMal¯ (Hydrogenmalat) vorliegt; man würde das am ersten Äquivalenzpunkt bei V=20 ml erwarten, aber in der Praxis liegen hier alle drei Spezies (H₂Mal, HMal¯, Mal²¯) nebeneinander vor. Deshalb gibt es auch keinen pH-Sprung, und die erste Ableitung zeigt nur ein äußerst kümmerliches Maximum, das erst bei Vergrößerung um den Faktor 1000 sichtbar wird. Das liegt natürlich daran, daß die beiden pKₐ-Werte recht eng beieinander liegen; bei der Zitronensäure ist es übrigens ähnlich.
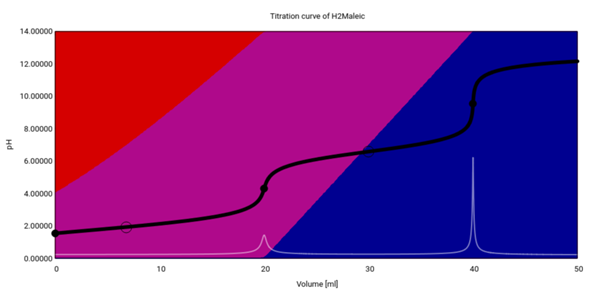
Als Gegenbeispiel zeige ich Dir hier noch die Maleinsäure mit den beiden pKₐ-Werten 1.93 und 6.58. Hier besteht am ersten Äquivalenzpunkt die Lösung wirklich ganz überwiegend aus dem Monoanion (Hydrogenmaleat), und deshalb gibt es einen pH-Sprung bei beiden Äquivalenzpunkten:

Vielen Dank schonmal für die Antwort. Aber wie genau muss man das dann formulieren? Gibt es hier einen Ansatz?