pH-Wert oder Konzentration der Oxoniumionen?
Hallo,
Ich habe die Korrektur zur folgender Tabelle mit dem Kommentar:"keine gute Darstellung da kein linearer Zusammenhang =》c nicht pH"
Aber wenn ich die Konzentration der Oxonium Ionen auf der x-Achse auftragen will, dann kommt ja das gleiche heraus. Kann mir jemand helfen?
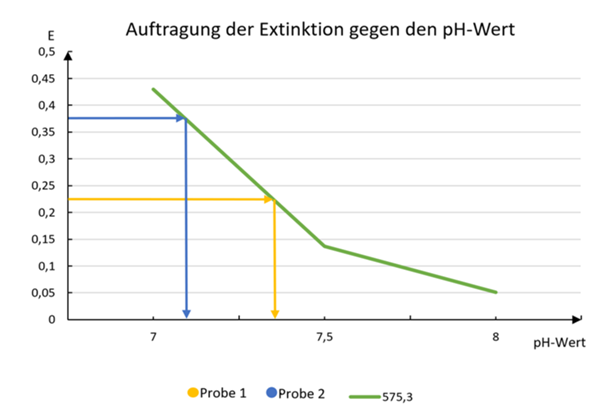
Wenn jemand wissen will die gesamte Versuch aussah.
Es wurden 3 Puffer angelegt mit pH 7 7.5 und 8. Untersucht wurden zwei Gewässerproben. Zu allen 5 Proben wurde Kresolrot als Indikator zugegeben und die Spektren mit Photometer ermittelt . An aussagekräftiger Stelle (575.3nm) wurde die Intensität gemessen und aktuell gegen bekannten pH-Wert der Puffer aufgetragen. Probe 1 und 2 kann man dadruch ja leicht ablesen.
Vielen Dank für eure Hilfe !!
1 Antwort
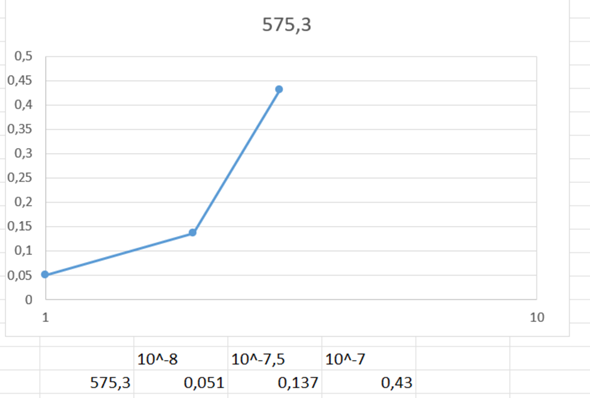
Der pH-Wert ist ein logarithmischer Wert, dadurch ergibt sich keine lineare Steigung bzw dieser knick. Das ist aber offensichtlich nicht gewollt. Wenn du die Konzentration aufträgst, ergibt sich dann mitnichten das gleiche, sondern eine tatsächliche Gerade. Probier das mal.
Und mit dem Kommentar "kein linearer Zusammenhang" ist wahrscheinlich das Lambert-Beer-Gesetz gemeint. Danach ist die Extinktion proportional zur Konzentration (und nicht zum pH-Wert).
Außerdem lässt sich dann auch einfacher die Konzentration der Proben ablesen.
Eben nicht. Beispiel: 2 ist auf der pH-Skala das doppelte von 1. Die entsprechenden Konzentrationen sind aber 0,1 und 0,01, also das 10 fache voneinander.
Trag das mal so auf, da sollte sich dann was ändern.
Danke!
Weißt du wie ich es vernünftig schaffe die X-Achse zu skalieren?
Sorry das ich Frage
Naja, fängst halt kurz vor 10^-8 an und endest kurz nach 10^-7. Dass das etwas gestreckt wird, ist normal. Du wechselst ja die Skala.
Kannst es ja nochmal rein stellen, wenn du fertig bist, dann kann ich dir sagen, was du noch machen könntest.
Danke! Habe es als neue Frage hochgestellt. Die Skalierung auf der X-Achse macht aber wenig Sinn. Die verwendeten Werte hab ich drunter gepackt
Vielen Dank für deine Antwort! Aber noch eine Frage dazu. Fir Konzentration des pH-Werts ist ja definiert als negativer dekadischer Logarithmus der Oxoniumkonzentration. Folglich wäre ja an den Punkten, wo bisher pH 7 unf pH 7.5 steht c=10^-7 und c=10^-7.5
Aber die Werte wären ja immernoch die gleichen oder nicht?
Vielen Dank für deine Hilfe