Lewis-Struktur von CO?
Grüßlimüsli,👋
ich versteh gerad die mittlere Darstellung der LEWIS-Formel von CO nicht so recht (rot markiert):
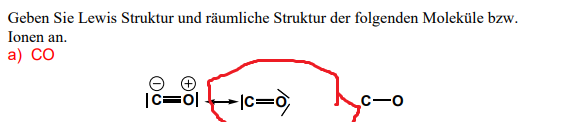
Da hat das C doch nur 6 Elektronen, oder?
2 Außenelektronen links und dann die 4 von der Bindung.
Es will doch 8 haben.
Wie kann das sein?
Tschüß 👋
1 Antwort
Da hat das C doch nur 6 Elektronen, oder?
Ja, aber dafür hat CO dann keine Ladungen mehr, was vorteilhaft ist. Außerdem zeigt die Struktur, dass die dritte Bindung formal eine dative Bindung von O zum C ist, weil C ja nur zwei Elektronen zur Dreifachbindung beisteuert, O aber 4.
Es will doch 8 haben.
Wie kann das sein?
Das ist ja auch nur eine formale mesomere Grenzstruktur. Im echten Molekül tritt kaum Ladungstrennung auf, wie man am unerwartet kleinen Dipolmomemt von CO sieht.
Durchaus. Deswegen ist das auch eine unwichtigere Grenzstruktur und spielt nur eine untergeordnete Rolle. Aber ganz null ist ihr Anteil eben nicht.
Aber gut, dass du das erwähnst. Das mit BF3 stimmt nämlich auch nicht so ganz. Hier hat man quasi den umgedrehten Fall zum CO. Formal hat das B zu wenig Elektronen. Man kann aber mesomere Grenzstrukturen zeichnen, bei denen es eine Doppelbindung zwischen je einem F und dem B gibt. Dadurch passt dann die Oktettregel, aber es entstehen Ladungen. Das wird auch durch Messungen bestätigt, dass das so ist. Denn die B-F Bindungen im BF3 sind deutlich kürzer als eine B-F Einfachbindung sein dürfte. Es gibt hier also einen nicht unerheblichen Anteil an π-Bindung.
Aber ist es denn nicht wichtiger, daß die Okettregel erfüllt ist?
Ich weiß daß es paar Ausnahmen gibt wie z.b. BF3, wo das Bor sich schon mit 6 Elektronen zufrieden gibt, aber ich dachte eigentlich immer, dass es bei den LEWIS-Formeln vorrangig darum geht, die Okettregel zu erfüllen, bevor man sich den Ladungen zuwendet.
Heißt dass wir nehmen lieber ein nicht erfülltes Okett beim Kohlenstoff in Kauf, haben dafür aber dann ein ungeladenes CO?
Also mir ist nicht so ganz klar, warum man jetzt einfach sagen kann wri nehmen dem C-Atom jetzt ein Elektronenpaar weg, um die Ladung auszugleichen.
Dachte Okettregel wär sozusagen das A und O, wenn man diese LEWIS-Formeln angeht. Und das mit dem Ladungsausgleich wär dann sozusagen "die Kür", nachdem man "die Pflicht" (Okettregel) erfüllt hätte.