Lewis-Formel aufstellen?
Lewis-Formel zu Kohlenstoffmonooxid (CO)
Lösung:
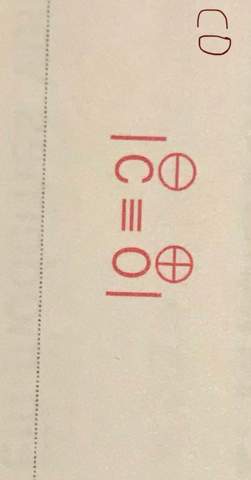
Meine Lösung:
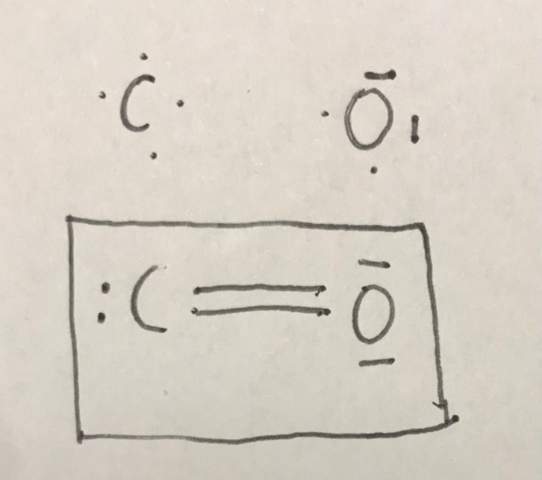
Warum ist es bei mir falsch? Was war die falsche Vorgehensweise? Denn laut Lösung hätte ein Kohlenstoff 6 Valenzelektronen, das stimmt doch gar nicht, denn es sind 4 Valenzelektronen?
Danke
1 Antwort
In der Lösung. hat Kohlenstoff 5 Valenzelektronen und ist negativ geladen. Sauerstoff hat 5 Valenzelektronen und ist positiv geladen.
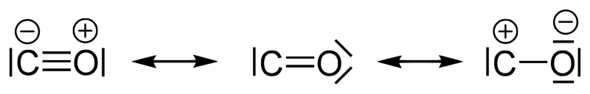
Sind sogenannte Grenzstrukturen, daher ist deine Lösung nicht falsch.
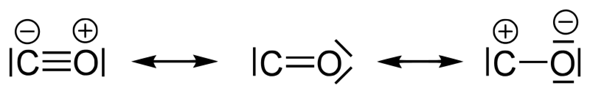
Das ist so üblich. Einzelne Elektronen werden eigentlich nur bei radikalischen Reaktionsmechanismen dargestellt.
achso, also immer wenn man zwei einzelne übrig bleibende Elektronen hat (bei Zeichnungen von Bindungen), verbindet man sie zu einer Elektronenpaarbindung (= einem Strich), obwohl wenn man Kohlenstoff nur in der Valenzstrichformel EINZELND zeichnen würde, es eigentlich gar keine Elektronenpaarbindung gäbe?
🥺
okay, vielen Dank, aber eine letzte Frage hätte ich noch:
bei meiner Lösung (zweites Abbild von Ihnen) habe ich die einzelnen Elektronen nicht zur einer Elektronenpaarbindung zusammengefasst (nur auf der linken Seite zwei Punkte, KEINEN Strich), denn es hat ja nur 4 Valenzelektronen und erst beim fünften Valenzelektronen gelangt es doch zu einer Elektronenpaarbindung (zu einem Strich). Wieso haben sie dann auf der linken Seite dann einen Strich also eine Elektronenpaarbindung?
Danke