Lewis Formel mit Kohlenstoffmonoxid?
Guten Tag liebe Community,
ich bin gerade ein wenig verwirrt, vielleicht könnt ihr eben Klarheit schaffen.
Bei der Verbindung wie Kohlenstoffmonoxid versuchen beide Atome durch eine Atombindung eine volle Außenschale zu erreichen, ist ja klar. Mich verwirrt nur diese dreifache Elektronenpaarbindung. Die ersten beiden sind ja logisch, Kohlenstoff stellt wie Sauerstoff zwei Elektronen zur Verfügung, aber die dritte Bindung? Kann das Sauerstoff sich einfach so denken, naja dann stelle ich halt zwei weitere Elektronen zur Verfügung, damit Kohlenstoff die auch nutzen kann, und bekomme dafür einfach mal nichts? Oder hat Kohlenstoff wirklich einfach 5 Außenelektronen in dem Fall?
Hoffentlich ist es verständlich. :)
Danke euch.
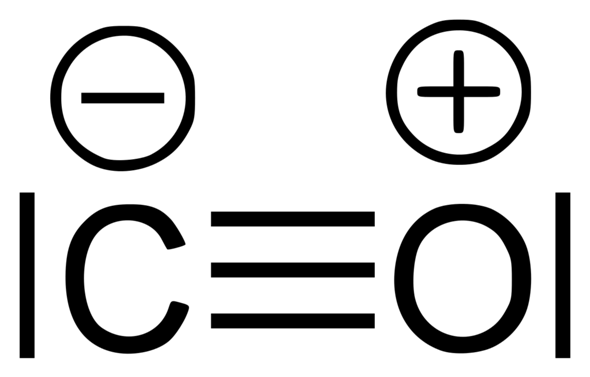
2 Antworten
Elektronen haben zwei Bestreben, um auf einem möglichst niedrigen Energieniveau zu sein:
- Möglichst nah am Kern zu sein, wegen der elektrischen Anziehung, logisch.
- Möglichst viel Raum einzunehmen, da die kinetische Energie sinkt, wenn der Raum weiter ist, wegen der Heisenbergschen Unschärfe.
Beim Kohlenmonoxid haben die Elektronen die Wahl zwischen Teufel und Belzebub, beides geht nicht. Deshalb ist Kohlendioxid auch (bei niedigen Temperaturen) instabil und zerfällt in Kohlenstoff und Kohlendioxid.
Und ja, CO hat ein deutliches Dipolmoment, mit der positiven Seite beim O-Atom.
Ja, so kann man es sehen, der Sauerstoff als selbstloser Spender eines Elektronenpaares. Oder den Kohlenstoff als rücksichtslosen Räuber desselben. Die beste Vorstellung ist aber, daß insgesamt zehn Elektronen in fünf Valenzorbitale eingefüllt, werden, von enen drei bindenden und zwei nichtbindenden Charakter habe — im Molekül wissen die Elektronen ja nicht, von welchem Atom sie ursprünglich stammen.