Valenzstrich-/Lewis Formel Formaldehyd?
Hallo Leute:)
Ich bin grade am Chemie lernen und bin nun beim Thema 'Lewis Formel' aufstellen. So, nun habe ich hier das Beispiel vom Formaldehyd, wie die richtige Valenzstrichformel aussieht seht ihr auf dem Foto bei Nr. 1. Ich verstehe aber nicht, wieso man es nicht zb. auch so malen kann wie bei Nr. 2.. hier sind ja auch alle regeln erfüllt, also wieso kann man es nicht auch so zeichnen?
Vielen dank schonmal im voraus :)
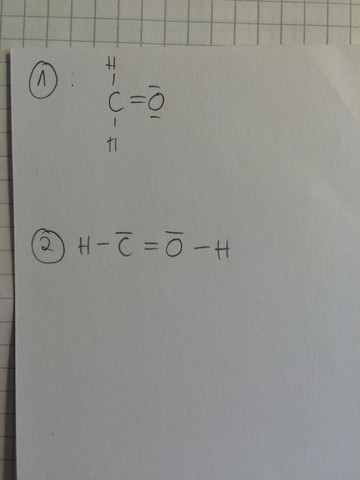
2 Antworten
Weil C vier elektronen braucht und O sechs
ahh, jetzt ist mir klar was du meinst, das hatte ich garnicht mehr bedacht und völlig außer acht gelassen! Ich dachte man zählt jeden valenzstrich zu jedem Atom einfach doppelt und muss dann quasi nur darauf achten, dass jedes Atom so zu seinen 8 Elektronen kommt. Ich hoffe du verstehst was ich meine:D
aber jetzt ist alles logisch, vielen vielen dank!!
Außerdem verstehe ich nicht, wie du auf die Idee kommst, dass du die Oktettregel korrekt angewandt hast. Zählt doch mal nach: O hat 5 Elektronen und C auch 5.
Du kannst ja mal schauen wo die Elemente im PSE stehen. C steht in der 4. Hauptreihe. O in der sechsten. Und du hast C und O gleichgesetzt, indem du gesagt hast, dass beide gleich viele elektronen haben und keine Ionen sind. Das bedeutet das auch beide gleich viele Protonen habe und Neutronen...und das bedeutet das sie gleich schwer wären
Ich verstehe es immer noch nicht ganz.. ich C und O streben doch beide die Oktettregel an.. und die ist doch auch im 2. Fall erfüllt, ich dachte quasi, das wäre vor allem das wichtige?
und was ist damit gemeint 'in meinem fall wahre C und O gleich schwer' ?
ich denke ich stehe grade ziemlich auf dem schlau :O
Weil es sich bei der 2. Struktur dann eben nicht mehr um Formaldehyd handelt. Du musst ja die Atome auch so verknüpfen, wie sie auch in echt verknüpft sind.
Die 2. Struktur ist bis auf die fehlenden Formalladungen erstmal so korrekt. Allerdings ist es eben nicht Formaldehyd und sieht doch sehr instabil aus...