Lewis-formel?
Hey Leute,
Ich wollte mal gern wissen, ob ich alles richtig habe. Und wenn noch ein paar amdere zum Üben gibt würde ich mich darüber sehr freuen 😁
1 Antwort
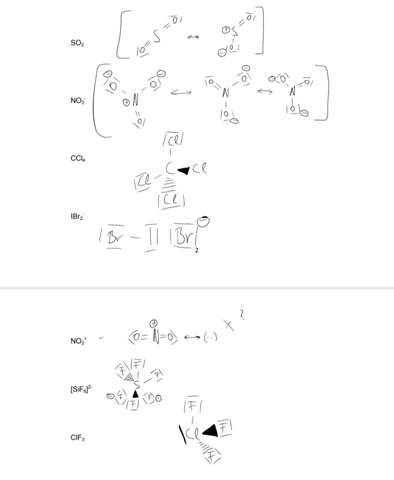
Beim SO₂ kannst Du noch eine dritte Grenzformel dazuschreiben, die die Formalladung am anderen O hat (so wie Du ja auch alle drei für NO₃¯ angeschrieben hast).
Das IBr₂¯ ist Gurke — Du hast das ja so aufgeschrieben, als ob ein Bromid plus das Interhalogen IBr wäre. Ein Bindung zwischen den beiden wäre gut. Das Iod hat dann drei lone pairs und zwei Bindungen und eine negative Formalladung — die VSEPR-Regeln sagen korrekt eine lineare Gestalt voraus (wie XeF₂, also formal trigonal–bipyramidal, mit den beiden Bromatomen in der axialen Position).
Beim SiF₆²¯ hast Du einen ähnlichen Murks gebaut. Das Si (nicht S) sollte sechs Bindungen und kein lone pair haben, die Form ist also oktaedrisch. Das Silicium hat zwei negative Formalladungen.
Beim ClF₃ ist Dir ein lone pair am Chlor verlorengegangen. Das Molekül ist T-förmig, nach VSEPR trigonal–bipyramidal mit einem F-Substituenten äquatorial und zweien in axialer Stellung.