Ist meine Zeichnung richtig (Magnesiumoxid, Lewisschreibweise)?
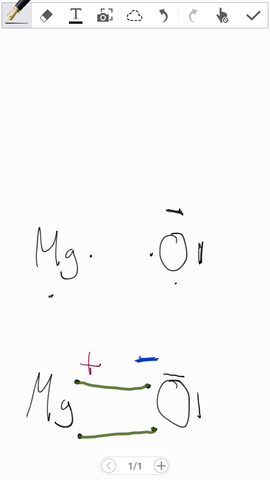
4 Antworten
Joa,
also wenn du an diesem Beispiel die Lewis-Schreibweise üben sollst, dann kann man das vielleicht schon so gelten lassen - zu Übungszwecken.
Problem 1) + und -: Formal müsstest du entweder "2+" und "2-" hinschreiben. Dann wäre das die "echte" Ladung. Oder du schreibst ein kleines Delta davor. Dann wäre es die Partialladung. Wenn du es so alleine stehen lässt, wäre es falsch.
Problem 2) Eigentlich handelt es sich um ein Salz. Die Bindung, die du da so schön hingezeichnet hast, gibt es gar nicht. Eigentlich sind das Ionen (Mg[2+] und O[2-]), die ein 3D-Gitter bilden.
=> Wenn man es ernst nimmt, ist die ganze Zeichnung deswegen falsch. Die beiden Elektronen des Mg werden vollständig an das O abgegeben. Mg hat 0. O hat 8.
=> Wenn du diese Aufgabe als Beispiel für die Lewisschreibweise bekommen hast, ist das zwar ein dummes Beispiel, aber von dir korrekt gelöst. Denn die Lewis-Schreibweise an Ionen zu üben, ist noch dümmer. ;)
LG
MCX
Also bei Ionen / Salzen würde ich entweder Mg²⁺ und O²⁻ schreiben und mir das ganze lästige Malen schenken.
Oder, wenn man der Sache ganz auf den Grund gehen will, malt man ein "Schalenmodell", sodass dann alle Elektronen drauf verzeichnet sind.
Das, was hier von dir verlangt wird, ist so ein Kuddelmuddel aus beidem. Wenn es hilft, mag das zu Übungszwecken ok sein, aber es ist von der Wahrheit recht weit entfernt. Das könnte man auch einfacher machen. :)
LG
MCX
MgO ist ein Salz. Salze bestehen aus Ionen, bilden ein Ionengitter.
Lewisformeln sind für Moleküle, also hier gar nicht anwendbar.
MgO im Speziellen kristallisiert im NaCl-Gitter, jedes Mg-Ion ist von 6 Oxid-Ionen umgeben, und umgekehrt. Die Anzahl der Gegenionen, auch Koordinationszahl genannt, hängt (hauptsächlich) vom Verhältnis der Ionenradien ab.
In einem Ionengitter sind nicht bestimmte Ionen mit bestimmten anderen verbunden, sondern alle mit allen, aufgrund der elektrostatischen Anziehung.
Prinzipiell ja, aber ich würde noch die Ladung dazu schreiben.
Prinzipiell NEIN, weil es keine gerichteten Verbindungen zwischen Mg und O gibt.
MgO ist eben ein Salz, da gibt es keine Atombindungen.
Etwas anders sieht es beim BeO aus, aber da gibt es 4 (tetraetrisch angeordnete) Bindungen zu 4 Gegenatomen. Jedenfalls würde ich BeO zumindest als Grenzfall zwischen kovalenterund ionischer Bindung einordnen.
noch was. Ich weiß nicht, ob das irgendwie ne Aufgabe aus der Schule ist oder so, aber Magnesiumoxid hat keine echte kovalente Doppelbindung, so wie sie hier gezeichnet ist. Das ist eine Ionengitter, wie im NaCl zum Beispiel.
Metalle und Nichtmetalle gehen keine Bindungen ein. Du musst sie getrennt aufzeichnen. Das Sauerstoff hat dabei 8 Valenzelektronen, Magnesium 0.
alter waaas?!?! ich höre zum ersten mal sowas..... jedes Element geht auf eine Bindung ein, was eine schwachsinnige Formulierung! Sauerstoff hat 6, Magnesium 2 Valenzelektronen, durch die Reaktion haben beide was davon, also wtf?
Jangler hat es etwas unscharf oder unglücklich ausgedrückt:
Metalle und Nichtmetalle gehen keine kovalenten oder Elektronenpaarbindungen ein.
OK, auch das gilt natürlich nur für "normale" Metall-Nichtmetall-Verbindungen, aber als Anfängerregel kann man es erst mal durchgehen lassen.
Kennst du die Regel Metall+Nichtmetall=Salz? Und Salze bestehen aus Ionen, da kannst du keine Lewisformel zeichnen.
Also etwas Vorsicht, bevor du etwas als schwachsinnig bezeichnest.
welche schreibweise ist denn die beste??