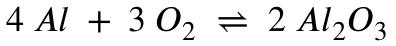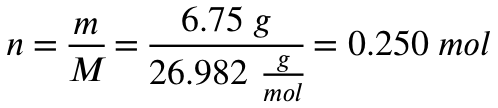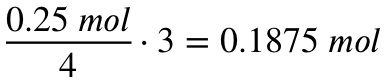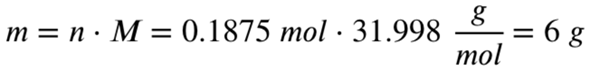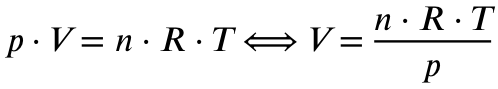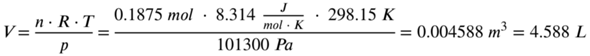Chemie Wunderkerze?
In einer Wunderkerze befinden sich 6,75g Aluminium. Berechne die Masse an Sauerstoff, die beim Abbrennen der Wunderkerze verbraucht wird. Ermittle das Volumen an Luft, das dieser Masse an Sauerstoff entspricht (bei 25°C).
1 Antwort
Dazu schauen wir uns als erstes die Reaktionsgleichung an:
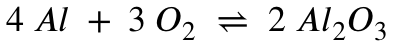
Nun errechnen wir mit der Molaren Masse von Aluminium, wie viel Mol 6,75 Gramm entsprechen:
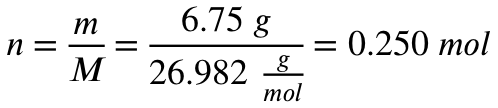
Aus der Reaktionsgleichung wird deutlich, dass wir zur Umsetzung von 4 Teilen Aluminium 3 Teile Sauerstoff brauchen. Also können wir mit der Angabe dieses Verhältnisses die benötigte Stoffmenge Sauerstoff zur vollständigen Umsetzung der 0,25 mol (6,75 Gramm) Aluminium berechnen:
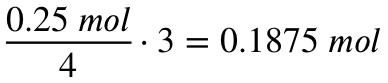
Mit der Molaren Masse von Sauerstoff rechnen wir das Ganze jetzt auf die absolute Masse von Sauerstoff zurück:
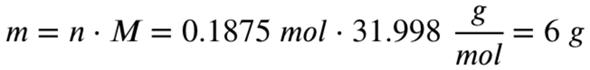
Du benötigst also 6 Gramm Sauerstoff zur vollständigen Umsetzung der 6,75 Gramm Aluminium.
Um jetzt das Volumen zu errechnen nutzen wir die ideale Gasgleichung:
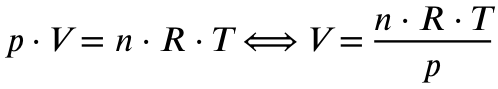
p = Druck in Pascal (nicht explizit genannt, ich gehe von Standardbedingungen von 1013 hPa aus, also 101300 Pa)
V = Volumen in Kubikmeter (gesucht)
n = Stoffmenge in mol (gegeben, haben wir vorher ausgerechnet, 0,1875 mol)
R = Ideale Gaskonstante (8,314 J/mol*K)
T = Temperatur in Kelvin (gegeben, 25 Grad Celsius entsprechen 298,15 K)
Nun setzen wir ein:
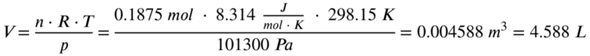
Die Menge an benötigtem Sauerstoff für die vollständige Umsetzung beträgt also 4,588 Liter bei 25 Grad Celsius und Normaldruck.