Wann sind Moleküle pyramidal aufgebaut?
Hallo schreiben bald Chemie und verstehe das Thema nicht so ganz. Wann sind Moleküle in der Lewis Formel pyramidal oder linear aufgebaut. Könnte dass jemand z.B an Methan (CH4) und Ammoniak (NH3) zeigen, danke für die Hilfe.
2 Antworten
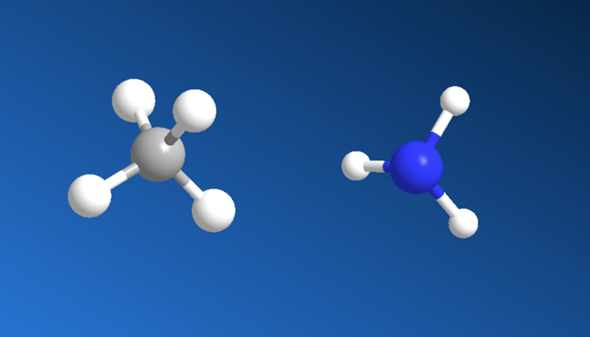
Also Methan ist tetraedisch und NH3 ist pyramidal. Das stellt man fest, indem man shcaut wieviele Bindungen der Stoff hat und wieiele Elektronenwolken freibleiben.
Der Kohlenstoff im Methan hat 4 Bindungen und 0 Elektronenwolken, deshalb ist er Tetraedisch.
Das N im NH3 hat 3 Bindungen und foglich noch 1 Elektronenwolke (2*3 = 6 Elektronen, also noch 2 dazu, dann sinds 8 fürs Oktett; kannst auch ausm periodensystem entnehmen, dass N 5 Elektronen hat davon 3 für die Bindungen, also 2 übrig als Elektronenwolke). Damit ist der Stoff pyramidal aufgebaut, weil bei der pyramidalen Form oben ein anderes ist und unten 3 gleiche. Also ist die 1 Elektronenwolke oben und unten die 3 H´s.
Schau Dir mal die beiden Moleküle an
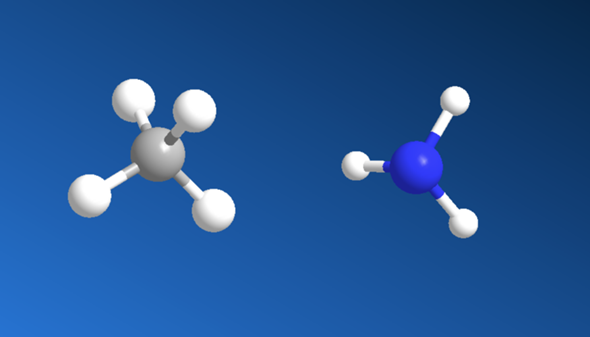
Links hast Du Methan, rehcts Ammoniak. Man könnte glauben Ammoniak wäre Planar aufgebaut weil ein vierter Substituent am Stickstoff fehlt, aber dem ist nicht so.
Der freie Elektronenpaar am Stickstoff benötigt auch Platz.
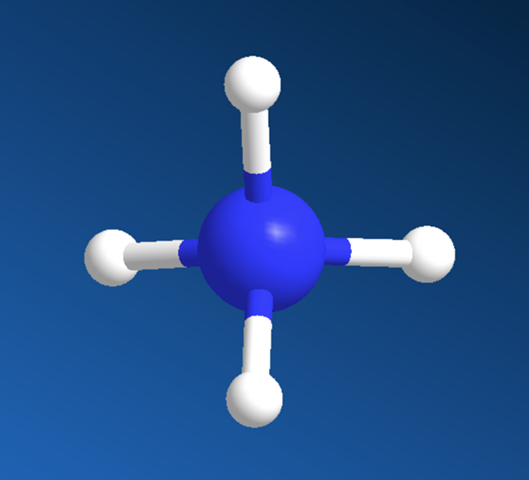
Generell ist der Aufbau so, dass die "Reste" stets den größtmöglichen Abstand zueinander haben (Vermeidung von Wechselwirkungen). Das erkennst Du beim Methan. Wenn Du dir beim Ammoniak (rechts) noch einen vierten Substituenten vorstellst
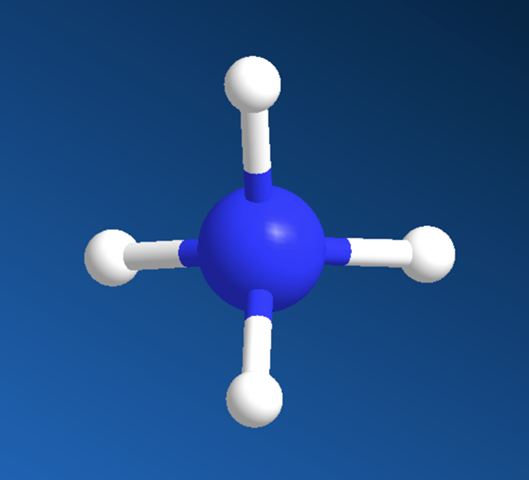
hier das Ammoniumion erkennst Du den "Trick" der dahinter steckt.