Valenzstrichformel von Phosphorpentoxid?
Heyho, gehe gerade ein paar klausurtypische Aufgaben durch:
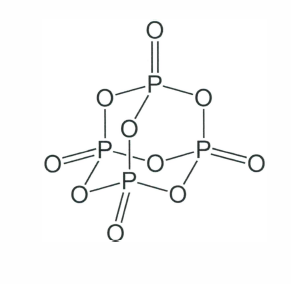
Folgende Frage: 1: Welches Problem besteht mit dieser Valenzstrichformel?
2: Zeichnen sie eine bessere Valenzstrichformel
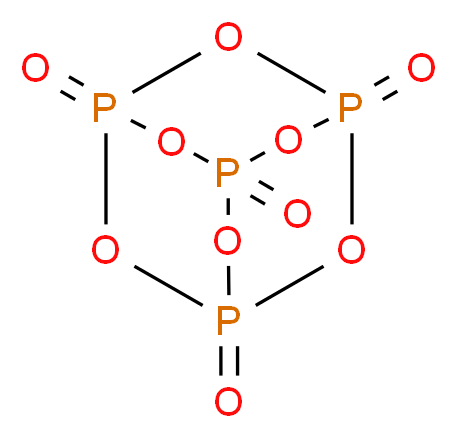
2: Im Inet habe ich noch diese Version gefunden
Sprich diese Version wäre besser?
3 Antworten
Moin,
nein, die zweite Version ist nicht besser, weil es die gleiche Darstellung (nur aus einer anderen Perspektive) ist.
Eine bessere Version wäre, wenn du alle doppelt gebundenen Sauerstoffatom zu einfach gebundenen machen würdest (weil dann die Phosphoratome die Edelgasregel erfüllen würden). Dann würde das zweite bindende Elektronenpaar vollständig an das entsprechende Sauerstoffatom gezeichnet werden (dann erfüllen auch alle Sauerstoffatome die Edelgasregel). In diesem Fall hätten dann die Phosphoratome jeweils eine positive Formalladung, während die Sauerstoffatome, die vorher über eine Doppelbindung mit den Phosphoratomen verbunden waren, eine negative Formalladung hätten.
LG von der Waterkant
Hannover, AC I? Aber vielleicht haben auch alle die gleichen Klausuraufgaben :D
Ich weiß noch, dass ich das letztes Jahr nicht wusste, aber ich glaube, es ging um die Hypervalenz beim Phosphor. Dass man stattdessen mit Ladugen arbeiten soll, also O- und P+ statt der Doppelbindungen, damit jeweils nur 8 e- bei den Atomen sind
Wobei das ja auch nicht sooo ein Problem wäre, m-E. hat Phosphor ja im Gegensatz zu Stickstoff noch ein paar d-Orbitale, die besetzt werden können.
Ich stimme dir aber zu, dass die Prüfer vermutlich das meinen... Gibt es niemanden in der Prüfungskommission, der da BEscheid weiß?
Es steht an der Seite 584 von dem Binnewies Buch "Allgemeine und Anorganische Chemie" :)
Finde die neueren Klausuren wesentlich schwerer als die die älteren, das lustige ist auch, dass ich kaum aufgaben aus dem übungszetteln in den klausuren finde, obwohl die ja eigentlich daraus stammen ^^
es sollte an der Seite 586 sein
wir sind uns nicht sicher, aber viel Erfolg, wir schreiben die Klausur trotzdem mit!!
Die ganze Altklausuren finde ich sehr schwer.