Strukturformel von phosphat?
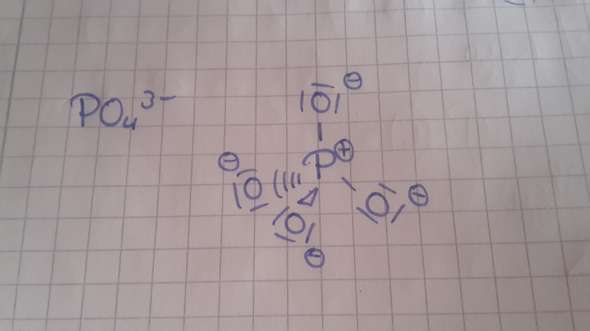
Ist die Strukturformel von Phosphat so richtig? Ich habe vier einfach-Bindungen
3 Antworten
Deine Lewis-Formel ist richtig. Es gibt allerdings weitere mit ein oder zwei doppelt gebundenen O-Atomen (weil P sein Elektronenoktett ausweiten kann). Die „richtige“ Formel ist eine Überlagerung zwischen allen Möglichkeiten, es liegt also Mesomerie vor.
Ne ein Sauerstoff-Atom muss eine Doppelbindung zum Phosphor-Atom haben
Also den ersten Schritt hast du schonmal richtig, aber in der Summenformel steht ja am Ende 3- und du hast grade 4- bei den Sauerstoff Atomen. Außerdem hast du bei dem Phosphor eine Positive Ladung. Du nimmst nun von einem Sauerstoff-Atom zwei ungebundene Elektronen und formst eine Doppelbindung um die positive Ladung in der Mitte auszugleichen. schau einfach immer auf die Anzahl der Ladungen und verteil dann die Elektronen dementschprechend. Wenn du gut in englisch bist kannst du dir auch das Video hier zum Verständniss anschauen.https://www.youtube.com/watch?v=gl4d80g6cow
Ergänzend: Der Phosphor kann (wie alle p-Elemente ab der dritten Periode) sein Elektronenoktett erweitern. So gibt es z.B. ein Anion PF₆⁻ mit einem Elektronendodezett.
Wenn Du das machst, was Emilolli richtigerweise vorgeschlagen hat (also ein nichtbindende O-Elektronenpaar zu einem bindenden hochadelst und eine negative Formalladung vom O zum P verschiebst), dann bekommst Du am P ein Elektronendezett. Da wir aber wissen, daß P bis zu 12 Elektronen verträgt, darfst Du das auch mit zwei verschiedenen O-Atomen gleichzeitig tun.
Nun bekommen wir aber ein Problem, denn diese Strukturen sagen verschieden lange P–O und P=O-Bindungen voraus, während das echte PO₄³⁻ exakte Tetraedersymmetrie hat. Deshalb muß man alle diese Formeln „überlagern“ (≈ mitteln) und erhält dann die richtige Form. Die Einzelformeln heißen „Grenzstrukturen“, und das Phänomen, daß man mehrere Grenzstrukturen zur Beschreibung braucht, nennt sich „Mesomerie“.
Mesomerie ist nicht selten und kommt z.B. auch bei SO₂, SO₃, SO₄²⁻ und sogar CO₃²⁻ vor, nicht aber bei CO₂ (beachte, daß beim C die Oktettregel stark gilt, da sind also keine Dezette oder Dodezette möglich).
Ne, 3 einfach und eine Doppelbindung.
Woher weiß ich das?