Siedepunkt unter Normalbedingungen bei gegebenem Tripelpunkt?
Hallo, wenn der Dampfdruck eines Stoffes am Tripelpunkt 5 bar beträgt, welche Aussage kann man dann über den Siedepunkt unter Normalbedingungen treffen?
Sieden ist ja der Phasenübergang von flüssig zu gasförmig. Liegt der Siedepunkt, da er Druck abhängig ist, unter Normalbedingungen, unter dem Tripelpunkt?
3 Antworten

Eine flüssige Phase kann es nur bei einem Druck höher als dem Tripelpunkt geben, das sieht man an jedem Phasendiagramm (hier eines für Wasser, weil sich das am leichtesten im Internet finden läßt):
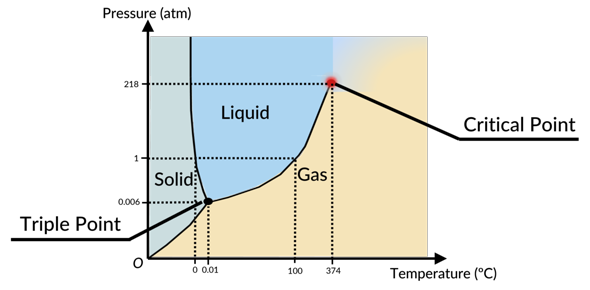
Wenn der Tripelpunkt wie in Deinem Beispiel oberhalb des normalen Atmosphärendrucks liegt, dann ist die Substanz bei normalem Druck garantiert nicht flüssig, sondern entweder fest wie UF₆, das beim Erhitzen sublimiert und nicht schmilzt, oder ein Gas wie CO₂, das beim Abkühlen direkt in den festen Zustand übergeht (dabei ist natürlich vorausgesetzt, daß man beim Erhitzen bzw. Abkühlen den Druck bei 1 bar läßt).
Folglich kann man die Aussage treffen: Die Substanz hat bei Normaldruck keinen Siedepunkt, weil sie bei keiner Temperatur flüssig ist und nur flüssige Stoffe sieden können.
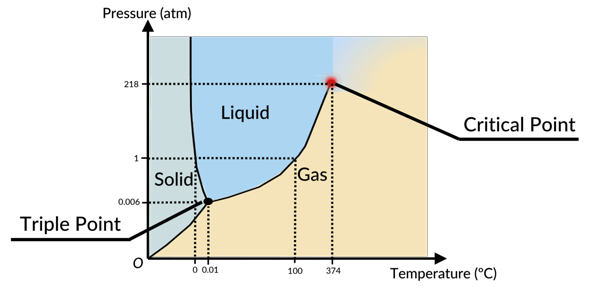


Unmittelbar gar keinen. Der Dampfdruck von Kohlenstoff am Tripelpunkt beträgt zum Beispiel 100 bar, unter Normalbedingungen ist Kohlenstoff fest. Uranhexafluorid hat am Tripelpunkt eine Dampfdruck von 1,5 bar und ist unter Normalbedingungen ebenfalls fest. Kohlendioxid liegt mit einem Dampfdruck von 5 bar in der Mitte, ist aber bei Normalbedingungen ein Gas.

Wenn der Tripelpunkt bei Überdruck liegt, kannst du von Gasform im Normalzustand ausgehen