Redox Reaktion?
Hallo,
Wir haben vor den Ferien das Thema Redoxreaktionen gehabt, worüber wir jetzt eine Hü schreiben. Theoretisch verstehe ich das, aber eben noch nicht ganz. Auf dem Bild ist eine "Musterlösung", jedoch ohne Reduktion/Oxidation Kennzeichnung.
Zinn (IV) oxid + Natrium -> Natriumoxid + Zinn
Folgendes verstehe ich nicht: Wieso steht unter dem ersten O eine 2? Ich denke nicht, weil Sauerstoff immer als zweiatomiges Molekül vorkommt, sonst wäre bei dem anderen O doch auch eine, oder? Oder ist die Lösung vieleicht doch falsch?
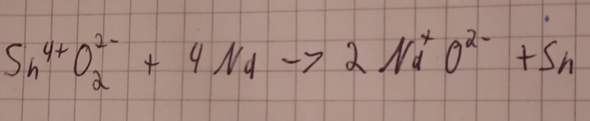
3 Antworten
Du beginnst mit Zinn(IV)oxid SnO₂ und reduzierst es mit Natrium zum Zinn. Da das Zinn dabei vier Elektronen aufnimmt (die Oxidationszahl fällt von +IV auf 0) und jedes Na-Atom nur eines liefern kann, brauchst Du dazu vir Na-Atome pro SnO₂-Einheit:
SnO₂ + 4 Na ⟶ 2 Na₂O + Sn
Der Fehler in Deiner Gleichung ist, daß die Formel von Natriumoxid falsch ist.
Das erste O ist ein Sauerstoffmolekül. Ungeladen. Da sind 2 O-Atome zusammen.
Am Ende müssen links und rechts die gleiche Zahl an Atomen stehen und die gleichen Ladungen.
Oha: Links sollte nur SnO2 stehen. Die Ladungen in den Molekülen zeigt man eigentlich nicht an. Und rechts Na2O. Dann hast du auch wieder alle 4 Na.
Die Indizes geben an, in welchem Verhältnis die Beteiligten Ionen in der jeweiligen Verbindung vorliegen. Im SnO2-Kristallgitter kommen also auf jedes Sn-Ion 2 Sauerstoffionen. Es gibt auch die Verbindung SnO, bei der im Kristallgitter genau ein Sauerstoffion pro Zinnion vorkommt. Einmal hat das Zinn die Oxidationszahl +IV und einmal +II.