pH-Wert Rechnungen, Milchsäurekonzentration?
Hey :)
Kann mir jmd. bei nachfolgender Aufgabe helfen? Ich komme einfach nicht weiter...
Welche Konzentration an Milchsäure ist nötig, damit der pH-Wert unter 5,0 sinkt? (pKs=3,86)
Ich habe den pH in die pH-Formel eingesetzt und versucht nach c aufzulösen, allerdings bekomme ich immer ein anderes Ergebnis, als vorgegeben... Woran liegt das?:/
Danke im Voraus für eure Hilfe
LG :)
3 Antworten

Da Milchsaeure als eine schwache Saeure gilt, bzw. Organische Saeuren sind im vergleich zu Inorganischen Saeuren fast immer schwaecher.
Es gilt :
Laut Aufgabe soll der pH Wert unter 5 sein, d.h. pH<5, bzw. :
Da ja kleiner als 5, ist die [H+] Konzentration groesser als (o.g.) :
Also :

Naja, der pKs Wert ist etwas zu niedrig als fuer eine Schwache Saeure und da kann man es vllt. auch als Mittelstarke Saeure sehen, und laut :
https://de.wikibooks.org/wiki/Formelsammlung_Chemie/_Berechnung_des_pH-Wertes
--> Kommt exakt der Wert 1,0724*10^(-5) M raus.
Bzw. :
[Milchs.]>1,0724*10^(-5) M.
Vorausgesetzt
Milchsaeure ist eine Mittelstarke Saeure... ?
Aber
Laut :
http://www.chemieunterricht.de/dc2/wsu-haush/kap_0413.htm
Ist Milchsaeure eine schwache Saeure.

Die Rechnerei von Plejaden123 zeigt deutlich, wie gefährlich es ist, wenn man sich auf Näherungsformeln verläßt. Milchsäure (pKₐ=3.86) ist zwar nicht besonders stark, aber bei pH=5 müssen die Alarmglocken schrillen. Das ist sehr wenig sauer, also wird die Milchsäure sehr verdünnt sein müssen, und je verdünnter umso stärker steigt der Dissoziationsgrad, bekanntlich gilt ja Kₐ=α²cₒ/(1−α). Die folgende Graphik zeigt das genauer (ich habe sie aus dem Massenwirkungsgesetz ohne weitere Näherungen berechnet).
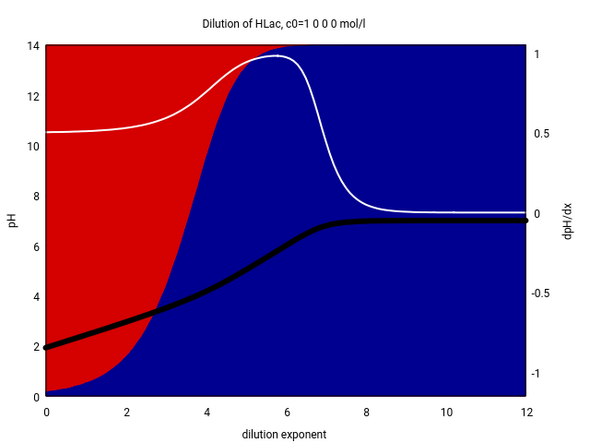
Die Abszisse gibt die Konzentration logarithmisch an (c=10⁻ˣ), die schwarze Kurve ist der pH, und die Hintrgrundfarben geben die relativen Mengen Säure (rot) und Anion (blau) an. Um auf pH=5 zu kommen, müssen wir auf etwa 10⁻⁵ mol/l gehen, und da ist der Dissoziationsgrad schon α>90%, also funktioniert die simple Formel c(H₃O⁺)=√(Kₐ⋅c₀) nicht mehr. Stattdessen müssen wir den vollen Weg nehmen.
wobei c₀ die gesuchte Einwaagekonzentration ist, und x ist die Konzentration der dissoziierten HA-Moleküle (und damit gleich der H₃O⁺- und der A⁻-Konzentration). Im Gleichgewicht bleiben von ursprünglich c₀ HA-Molekülen nur noch c₀−x übrig. Da x nicht viel kleiner als c₀ sein wird (ein merklicher Anteil der Moleküle dissoziiert), können wir nicht c₀−x≈c₀ setzen, wie man das sonst oft tut und dann bei den bekannten Näherungsgleichungen landet.
Laut Angabe soll x=10⁻⁵ mol/l sein, wir wissen also alles bis aufs c₀ und können die Gleichung auflösen: c₀=x²/Kₐ+x=1.072⋅10⁻⁵ mol/l.


Natuerlich ist der sicherste weg mit dem Gleichgewicht, aber der Nachteil hierbei ist dass die Mehrheit der Studenten, Schueler, etc., halt die Formeln fuer die Saeuren/Basen auswendig lernen, und somit fuegt man einfach die ggb. Werte in den Formeln ein, und man bekommt das raus was man will.
Wohingegen mit der o.g. Formel fuer Mittelstarke Saeuren exakt dass gleiche Ergebnis herauskommt, aber ich habe halt den Fehler am Anfang gemacht dass ich halt sofort die Saeure als schwach genommen habe, obwohl der pKa zur Mittelstarke Saeure geht....
Dennoch ist die Berechnung mit den Gleichgewicht am sichersten, aber wohl leichter auswendig gemerkt werden Formeln, schwache Saeuren/Basen, Mittelstarke Saeuren/Basen, etc., und dann einfach die Werte einfuegen....

Ich merk mir diese dämlichen Formeln nicht, stattdesen habe ich mir ein Programm geschrieben, das eine dreibasige Säure (mit beliebigen Mengen HCl oder NaOH dazu) allgemein löst.
Seitdem mache ich bei diesen Rechnungen keine Fehler mehr, außer daß ich manchmal mit C&P die falsche Zahl aus dem Output herausfische. ☺

acuh den richtigen -log gewählt

Hey, danke erstmal, ich kann deinen Lösungsweg ziemlich gut nachvollziehen, allerdings steht in meiner Musterlösung 1,072*10^-5 und nicht dein Ergebnis, das verstehe ich jetzt nicht, weil deine Lösung eig total logisch aussieht...