Orbitale?
Hey Leute,
Ich hab bisschen Probleme mit der Bildung der LGOs. Hab ich das richtig gemacht oder fehlt noch was?

1 Antwort
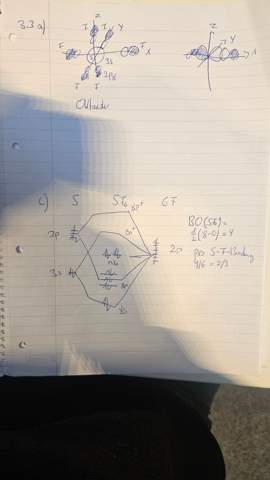
Ich vermute, Du willst wissen, wie die Ligandenorbitale symmetrieadaptiert für Oₕ aussehen. Ich lege die Ligandenorbitale auf die Koordinatenachsen und nenne sie ψ₁ (x⁺-Achse), ψ₂ (x¯-Achse), ψ₃ (y⁺-Achse) usw. bis ψ₆ (z¯-Achse). Jetzt bauen wir symmetrieadaptierte Linearkombinationen (Normierung lasse ich weg), und dazu hilft es zu wissen, daß diese sechs Funktionen eine reduzible Darstellung a1g ⊕ eg ⊕ t1u haben. Alle Ligandenorbitale sehen gleich aus, man kann sie sich als s-Orbitale vorstellen, mit einer Beimengung von p in der Bindungsachse (also ein unsymmetrisches p mit zwei unterschiedliche großen Lappen); sie zeigen alle mit dem großen Lappen und mit demselben Vorzeichen zum Zentralatom
- Eine rundum positive Linearkombination ψ₁+ψ₂+ψ₃+ψ₄+ψ₅+ψ₆ transformiert sich totalsymmetrisch, also a1g.
- Dann haben wir drei Linearkombinationen {ψ₁+ψ₂, ψ₃+ψ₄, ψ₅+ψ₆}, die eine dreidimensionale Darstellung bilden. Man sieht ohne Mühe, daß sich diese Funktionen wie die kartesischen Koordinaten transformieren, also t1u. Natürlich kann man die auch anders anschreiben, aber so ist es mit Abstand am einfachsten. Innerhalb von mehrdimensionalen Darstellungen kann man ja frei linearkombinieren.
- Zuletzt bleibt das eg übrig, und wir wissen natürlich, daß das ungefähr so wie die d-Orbitale x²−y² und z² aussehen muß, also so wie {ψ₁+ψ₂−ψ₃−ψ₄, ψ₅+ψ₆} (zeichne es auf, wenn Du nicht verstehst, wie man das sofort sieht).
- Wenn Du Zweifel hast, daß das richtig ist, dann mußt Du Dich damit abplagen, die Orthogonalität zwischen den Funktionen zu zeigen. Ich spar mir das, weil die Symmetrie das sowieso garantiert.
Warum wählt man die genauso? Ich verstehe die Frage nicht. Entweder ist gefragt, warum man überhaupt symmetrieadaptiert; die Antwort ist, daß man damit das Problem vereinfacht, weil man nur die Interaktion von Orbitalen gleicher Symmetrie berücksichtigen muß. Oder es ist gefragt, warum man genau diese Symmetrieadaptierung wählt und keine andere, gleichwertige; darauf weiß ich keine gute Antwort, außer das es so ganz brauchbar aussieht.
In der letzten Frage willst Du wissen, wie das mit der Bindung im SF₆ bestellt ist; ich nehme an, Du modellierst es aus den sechs Ligandenorbitalen (die für F¯ stehen) und als Zentralatom ein S⁶⁺, das also in den 3s und 3p völlig leer ist. Jetzt kann Elektronendichte von den Fluorid-Liganden in das Zentralatom fließen, aber nur innerhalb derselben irreduziblen Darstellung; deshalb haben wir da die Symmetrieadaptierung gemacht.
In Oₕ transformiert sich s natürlich totalsymmetrisch als a1g, und p als t1u (notfalls Blick in Charaktertafel werden). Von den Ligandenorbitalen fließen Elektronen in die Schwefelorbitale gleicher Symmetrie; wir bekommen also vier Bindungen (a1g, und t1u), die verbleibenden eg-Ligandenorbitale sind nichtbindend, weil der Schwefel keine geeigneten Orbitale zum Auffüllen hat.
Letzteres ist natürlich nur näherungsweise richtig; realistisch würde ich mit einem stark bindenden S–F-Orbital rechnen (a1g), zwei etwas schwächeren (t1u) und zwei wirklich schwachen (eg). In diesem einfachen Modell nehmen wir ja an, daß die Orbitale immer gleich aussehen und nur innerhalb der Symmetrieklasse wechselwirken. Real deformieren sie sich aber auch, und deshalb können auch die eg-Ligandenorbitale leicht bindenden Charakter bekommen (ihre Lappen werden zum Schwefel gezogen); in einer ab-initio-Rechnung würde man das durch radiale Flexibilität im Basissatz und außerdem Polarisationsfunktionen am Schwefel berücksichtigen.