M2SO4?
Heyyy Leute kann mir irgendjemand , der ein Genie in chemie ist, helfen 😁
Wie kann ich das lösen? Danke im voraus
5,34 Gramm Salz mit der Formel M2SO4 (M steht für Metall) wird in Wasser gelöst. Fällt man das Sulfation mit Bariumchlorid aus, erhält man 4,66 Gramm Bariumsulfat
a) Berechnet = Anzahl der als Bariumsulfat ausgefällten Sulfatmol-Ionen
b) die Anzahl der Salzmole bei 5,34 Gramm und die Molmasse dieses Salzes
c) relative Atommasse des Metalls M
2 Antworten
Die Stoffmenge der beiden Massen muß dieselbe sein, also verhalten sich die Massen wir die molaren Massen. Das kann man einfach anschreiben, und dann die molaren Massen soweit berechnen wie, es eben möglich ist. Die molare Masse des unbekannten Metalls M nennen wir dabei x:
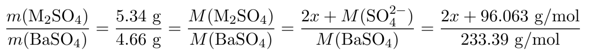
Und das muß jetzt nur noch nach x aufgelöst werden. Die Lösung ist Rb₂SO₄
.
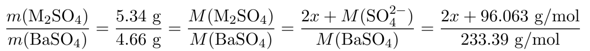
da braucht man eigentlich kein Genie zu sein.
a) aus der Formel für BaSO4 kannst du dir das Massenverhältnis Ba zu SO4 herausrechnen. Per Dreisatz erhälst du die Molmengen in 4,66g. Das ist deine Antwort. Falls du nicht nur die Molmenge, sondern auch die Anzahl Ionen berechnen sollt, benötigst du die Avogadro Zahl. (Glaub ich aber gar nicht, daß das die Frage ist. Passt nämlich nicht zum Rest)
b) Per Dreisatz kannst du die bei a) errechnete Molmenge auf die gleiche Molmenge des Ursprungsalzes zurückrechnen, also auf die 5,34g
c) Die Differenz bei a) und b) liefert die Antwort.
m.f.G.
anwesende