Hat jemand Rechnungsansätze für diese Thermoaufgabe?
Hallo, ich habe folgende Aufgabe aber komme dabei nicht weiter. Kann mir jemand helfen? Ansätze reichen hoffentlich vollkommen aus. LG
Heizwert und spezifische CO2 Emissionen von Methan und Propan bestimmen
Zum Heizen wird in Häusern häufig Erdgas verwendet, dessen Hauptbestandteil Methan ist. Wenn ein Erdgasanschluss, z.B. in ländlichen Regionen nicht verfügbar ist, findet auch Propan als Heizgas Anwendung.
Die Molmasse von C beträgt 12 g/mol, die Molmasse von H beträgt 1 g/mol, die Molmasse von O betrögt 16 g/mol.
a. Stellen Sie die Reaktionsgleichungen für eine vollständige Verbrennung von Methan und Propan auf.
b. Bestimmen Sie den unteren Heizwert von Methan und Propan.
c. Berechnen Sie die spezifischen CO2 Emissionen [kgCO2/MJ] von Methan und Propan.

Hast du wenigstens irgendeinen Ansatz?

a)1.Methan: CH4 + 2O2 -> CO2 + 2H2O
2.Propan: C3H8 + 5O2 -> 3CO2 + 4H20
c)Spezifische CO₂-Emissionen=Unterer Heizwert/Masse von CO₂
Das ist leider alles, bisher. bitte korrigiert mich
1 Antwort

aber komme dabei nicht weiter.
Und bis wohin bist du gekommen? Kannst du eine Reaktionsgleichung aufstellen?
a)1.Methan: CH4 + 2O2 -> CO2 + 2H2O
Das stimmt schon mal.
Nun berechnen wir den unteren Heizwert. Beim Heizwert geht man davon aus, dass alle Verbrennungsprodukte (insbesondere Wasser) gasförmig vorliegen. Lässt man das Wasser kondensieren, erhält man zustäzliche Energie und dann spricht man vom Brennwert. Der Brennwert ist also immer größer als der Heitzwert.
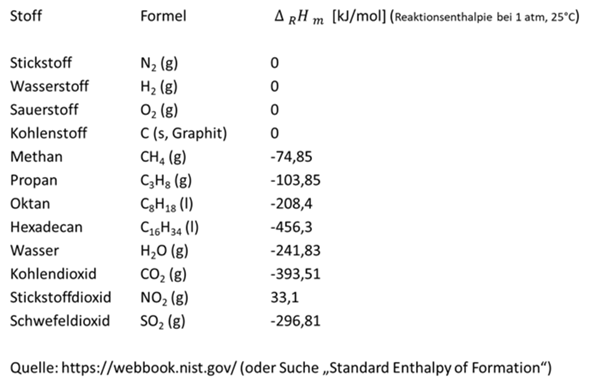
Den unteren Heizwert Hu errechnet man, indem man von den Standardbildungsenhalpien der Edukte die der Produkte abzieht.
Zunächst berechnen wir die molare Reaktionsenthalpie H_m
Methan:
CH4 + 2O2 -> CO2 + 2H2O
H_m = (-393,51 + 2 * (-241,83) - (-74,85 - 2 * 0) kJ/mol = -802,32 kJ/mol
Das negativer Vorzeichen bedeutet, dass die Reaktionswärme frei wird.
Den müssen wir umrechnen in den spezifischen Heizwert, wobei spezifisch immer bedeutet "pro 1 kg". Dabei wird üblicherweise auch das Vorzeichen umgedreht, sodass der Heizwert positiv ist.
1 mol CH4 = 12 g + 4 * 1 g = 16 g
1 kg Methan enthält demnach n Mole:
1 kg = n * 16 g
n = 1000 g / 16 g/mol = 62,5 mol
Damit ergibt sich der spezifische untere Heizwert Hu zu:
Hu = -H_m * n = 802,32 kJ/mol * 62,5 mol/kg = 50145 kJ/kg = 50,145 MJ/kg
c) Nun müssen wir ausrechnen, wieviel kg CO2 bei der Verbrennung von 1 kg Methan entsteht:
1 mol CO2 = (12 + 2 * 16) g/mol = 44 g/mol
Da 62,5 mol CO2 entstehen entsprticht das einer Masse m_co2 von
m_co2 = 44 g/mol * 62,5 mol = 2750 g = 2,75 kg
Nun können wir die spezifischen CO2 Emissionen berechnen:
Em_co2 = 2,75 kg / 50,145 MJ = 0,055co2/MJ

a)1.Methan: CH4 + 2O2 -> CO2 + 2H2O
2.Propan: C3H8 + 5O2 -> 3CO2 + 4H20
c)Spezifische CO₂-Emissionen=Unterer Heizwert/Masse von CO₂
Das ist leider alles, bisher


Achso und für Propan geht man dann identisch vor richtig? Nur eben mit den angepassten werten. Ist die Reaktionsgleichung denn für Propan auxh korrekt?

Achso und für Propan geht man dann identisch vor richtig?
Richtig. Deshalb habe ich mir das auch gespart.
Ist die Reaktionsgleichung denn für Propan auxh korrekt?
Ja, links und rechts stehen gleichviele Atome von jeder Sorte.
bitte korrigiert mich