Elektronenkonfiguration?
Hallo Freunde!
Laut meines Wissens ist die Reihenfolge: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f (Ungefähr, vllt hab ich mich am Ende verschrieben).
Jetzt passiert es mir aber, dass meistens die tatsächliche Reihenfolge eines Atoms anders ist, zB bei Silber. Gilt die Reihenfolge oben, als allgemein richtig (in der Prüfung) auch wenn die tatsächliche Reihenfolge anders ist? (Kann ich dann für zB. Silber [Kr] 4d10 5s1 auch [Kr] 5s2 4d9 schreiben? Das meinte ich eigentlich mit der Reihenfolge, weil ich dachte ich besetze 5s vor 4d?)
Außerdem gibt es ja manche Atome bei denen zB 3d vor 4s kommt, weil es besser ist ein Orbital komplett einfach zu besetzen oder?
MFG Mahuri
3 Antworten
Es gibt zwar eine Reihe von Ausnahmen von dieser Reihenfolge, die den Namen Madelung-Schema hat. Aber nur bei den Übergangselementen incl. Lanthaniden und Actiniden. Beim Caesium musst du dich vertan haben.
3d kommt bei der Erstbesetzung nie vor 4s, allerdings gilt das nicht für Ionen. Bei denen gehen die 4s als erstes verloren. Zn²⁺ hat z.B. die Konfiguration [Ar] 3d¹⁰.
Wierum du es schreibst, is egal. Es ist ja ein Ist-Zustand für das Silberatom, keine Historie vom Rb bis zum Ag. Allerdings solltest du den Ist-Zustand schon korrekt aufschreiben, der liegt nicht in deinem Belieben.
[Kr] 4d¹⁰ 5s¹ ist so richtig wie [Kr] 5s¹ 4d¹⁰, [Kr] 4d⁹ 5s² so falsch wie [Kr] 5s² 4d⁹.
Nochmal: Du besetzt gar nichts. Das macht die Natur. Die energetische Reihenfolge der Orbitale ist nicht in Stein gemeißelt, ist bei der Erstbestzung anders als bei der Ionenbildung.
Ich verstehe noch nicht ganz was du mit dem Schluss meinst. Die Reihenfolge habe ich richtig angewendet, aber die trifft nicht für alle Atome zu (vorallem die größeren)? Also kann ich gar nicht wissen wie die tatsächliche Reihenfolge aussieht?
Es gibt Ausnahmen oder Anomalien. In höheren Perioden nehmen die noch zu. Die kann man sich merken oder auch nicht. Fürs Erste reicht es, wenn du dir Chrom und Kupfer merkst.
Und noch mal: Es geht um keine Reihenfolge, sondern um Istzustände.
Seilnacht gibt diese Konfiguration aus:
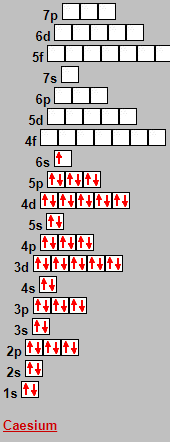
Ich kann nicht erkennen, wo hier die Reihenfolge der Energieniveaus der Schalen von der erwarteten abweicht.
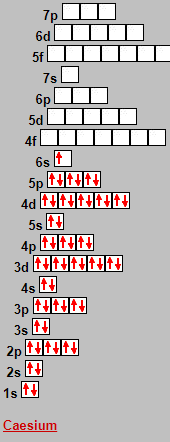
Naja das liegt an der Hundschen Regel, die besagt, dass halb und vollbesetzte Orbitale besonders stabil sind. Somit kann es energetisch stabiler sein, wenn ein Elektron aus einem S orbital in ein d Orbiatl wechselt. Das ist der Fall bei Elementen der 1. 2. und 5. Nebengruppe.
Habe mich vertan denk ich. Kann ich dann für zB. Silber [Kr] 4d10 5s1 auch [Kr] 5s2 4d9 schreiben? Das meinte ich eigentlich mit der Reihenfolge, weil ich dachte ich besetze 5s vor 4d?