Ist diese Elektronenkonfiguration richtig?
(Ich schrieb jetzt mal nur die letzten Buchstaben und Zahlen hin)
4s^2 3d^1
Im Internet steht das "3d^1" vor 4s^2 ist
Also ist das wie ich das dort oben geschrieben habe falsch?
Unser Lehrer erklärte uns etwas davon, dass man das auch tauschen muss in einigen Fällen weil das Atom dann stabiler ist.
In welchen Fällen muss man das denn anders rum aufschreiben damit das Atom seine stabilität bekommt?
3 Antworten
Moin,
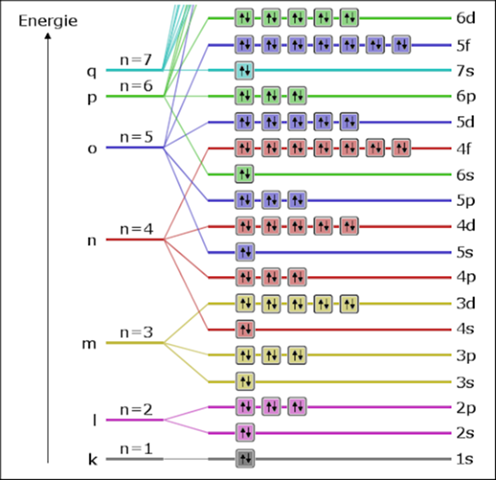
das ist so: Für die Besetzung von Atomorbitalen im Grundzustand (energieärmster Zustand) gibt es gewisse Regeln. Eine davon ist die Energie-Regel. Sie besagt, dass Atomorbitale von innen nach außen befüllt werden müssen. Oder besser gesagt, erst werden die energieärmeren (inneren) Orbitale befüllt, dann die energetisch ungünstigeren.
Nun ist es so, dass das 4s-Orbital energetisch etwas günstiger liegt als die 3d-Orbitale. Darum ist es korrekt, wenn du
4s^2 3d^1
schreibst. Wegen der Besetzung der Orbitale gemäß der Energie-Regel schau mal hier:

Hier siehst du, dass das 4s-Orbital energetisch günstiger liegt als die 3d-Orbitale. Darum wird das 4s-Orbital gemäß der Energie-Regel zuerst mit Elektronen besetzt:

Hier siehst du, in welcher Reihenfolge die Orbitale mit Elektronen besetzt werden.
Aber du siehst auch, dass die 3d-Orbitale formal zur M-Schale (also zum 3. Hauptenergieniveau) gehören.
Wenn du also die Elektronenkonfiguration aufschreibst, kannst du dich entweder dafür entscheiden, gemäß der Energie-Regel die Orbitale in der Reihenfolge der Besetzung mit Elektronen zu nennen (dann wäre dein ... 4s^2 3d^1 richtig) oder du klapperst alle Orbitale ab, die formal zum gleichen Hauptenergieniveau gehören (dann wäre ... 3s^2 3p^6 3d^1 4s^2 richtig).
Die erste Möglichkeit hat den Vorteil, dass sie mit der Energie-Regel korreliert. Die zweite Version hat dagegen den Vorteil, dass man sich die energetische Besetzung der Orbitale noch höherer Energieniveaus meist nicht merkt, aber dann bei der Aufzählung nichts vergisst (wer merkt sich schon, dass die Reihenfolge 6s, 4f, 5d, 6p... lautet?).
Was die Bemerkung deines Lehrers bezüglich der Vertauschung der Reihenfolge angeht, so könnte es sein, dass er auf Ausnahmen von der Energie-Regel anspielte und du das anders verstanden hast.
Außer der Energie-Regel gibt es nämlich auch noch die Regel der halb besetzten Orbitale. Sie besagt, dass es bei energetisch ähnlichen Orbitalen günstiger sein kann, diese halb zu besetzen, als das günstigere voll und das ungünstigere „irgendwie”.
Nimm als Beispiel die Besetzung der Orbitale beim Chromatom. Das hat 24 Elektronen. Streng nach der Energie-Regel müsste die Besetzung deshalb
1s^2, 2s^2 2p^6, 3s^2 3p^6, 4s^2, 3d^4
lauten.
Die tatsächliche Besetzung ist aber
... 4s^1, 3d^5
Das liegt daran, dass im letzten Fall sowohl das 4s-Orbital als auch die 3d-Orbitale alle mit Elektronen halb besetzt sind. Die Besetzung 4s^2 führt zwar zu einem vollbesetzten 4s-Orbital, aber die 3d-Orbitale wären „irgendwie” besetzt...
Auch beim Kupferatom gibt es eine solche Abweichung. Hier sind 29 Elektronen zu verteilen. Die Besetzung lautet
1s^2, 2s^2 2p^6, 3s^2 3p^6, 4s^1, 3d^10
Nach der Energie-Regel wäre aber eigentlich 4s^2, 3d^9 zu erwarten. Doch dann hätte man ein voll besetztes 4s-Orbital und „irgendwie” besetzte 3d-Orbitale. Im tatsächlichen Fall ist dagegen das 4s-Orbital halb besetzt, wohingegen die 3d-Orbitale voll besetzt sind. Das ist energetisch offenbar günstiger.
Doch so etwas geht nur bei energetisch ähnlichen Orbitalen...
Und wenn du in höhere Energiestufen schaust, wirst du auf Abweichungen stoßen, die mit so einfachen Regeln wie der Energie-Regel oder der Voll- und Halbbesetzung von Orbitalen einfach nicht verständlich sind, doch das steht auf einem anderen Blatt.
Fazit: Du kannst die Besetzung der Orbitale so hinschreiben, wie sie gemäß der Energie-Regel korrekt ist (deine Schreibweise) oder du kannst formal danach gehen, welche Orbitale zu einer Schale gehören. Du solltest das nur einheitlich machen...
LG von der Waterkant

Das ist dieselbe Konfiguration, die von Sc, nur eine andere Schreibweise. Die Konfigurationen sind Zustände, nicht Resultate einer Entwicklung. Das kannst du daran sehen, das Cr die Konfiguration 4s¹ 3d⁵ hat, somit eine Anomalie darstellt, oder am Ion Mn²⁺ mit der Konfiguration 3d⁵.
Um abzukürzen schreibt man normal das vorhergehende Edelgas davor, für Sc also [Ar] 4s² 3d¹. Oder [Ar] 3d¹4s², das ist Geschmackssache.
Wenn du dir diesen Link anguckst und zeilenweise vorgehst, wirst du sehen wieso 3d "vor" 4s kommt. Die 3d-Orbitale beginnen in der gleichen Zeile wie die 4s. Du gehst trotzdem von links nach rechts vor.
https://de.wikipedia.org/wiki/Elektronenkonfiguration#/media/Datei:Periodic_Table_2.svg