Chemie Teilchen Reaktion?
Eine Frage
H3PO4 kann ist j eine 3 protonige säure und kann dreimal protonen abgeben
Meine Frage ist warum sie in Wasser alle 3 abgibt
H3PO4+3H2O->PO4"3-+3H30"+
Aver dann gibt es noch Reaktionen wie
H3PO4+NH3->H2PO4"-+NH4"+
Meine Frage ist einfach wann reagiert es mehrstufig und wann nicht
Und die zusatzfrafe wäre Warum ist es kein ampholyt
2 Antworten
Meine Frage ist warum sie in Wasser alle 3 abgibt
Nein, die Frage ist, ob sie in Wasser alle drei Protonen abgibt. Und die Antwort ist Nein.
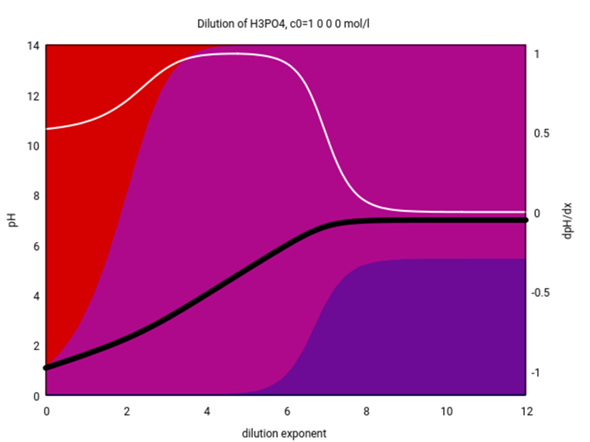
Auf der horizontalen Achse ist die Verdünnung aufgetragen, und zwar logarithmisch; daher bedeutet −4 eine Konzentration von 10⁻⁴=0.0001 mol/l. Die schwarze Kurve zeigt den pH der resultierenden Lösung, und die weiße ist die erste Ableitung davon.
Die Hintergrundfarben zeigen die Ionisierung: Undissoziierte H₃PO₄ (rot) dominiert im Konzentrationsbereich ≈1 mol/l, den Phosphorsäure ist ja nicht besonders stark und dissoziiert in konzentrierter Lösung nur wenig; unterhalb von 0.01 mol/l ist das erste Proton aber fast vollständig abgegeben. Zwischen 0.01 mol/l und 0.00001 mol/l dominiert das H₂PO₄⁻-Ion (rotviolett), und nur bei noch geringeren Konzentrationen kommt auch das HPO₄²⁻ (blauviolett) vor. Die dritte Dissoziationsstufe wird gar nicht beobachtet.
Also: Bei vernünftigen Konzentionen c>10⁻⁵ mol/l verhält sich H₃PO₄ in Wasser wie eine mittelstarke einbasige Säure.
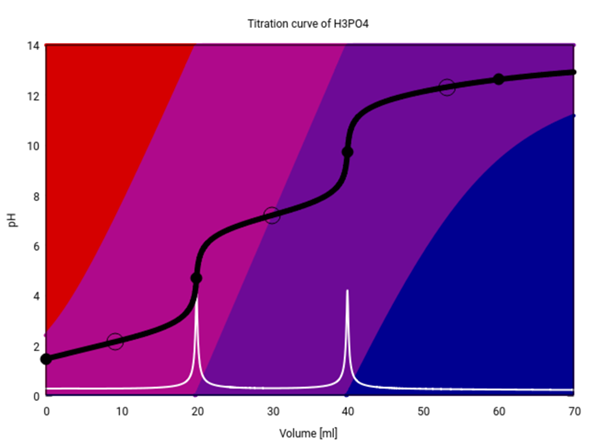
Wenn Du PO₄³⁻ haben willst, dann muß die Lösung ordentlich alkalisch sein. Das kannst Du nicht erreichen, indem Du H₃PO₄ in Wasser löst — da gilt ja immer pH≤7. Selbst bei Titrationen, wenn mn also H₃PO₄ mit Natronlauge neutralisiert, bekommt man nur ganz am Ende merkliche Mengen PO₄³⁻, wie die folgende Titrationskurve zeigt (20 ml 0.1 mol/l H₃PO₄ titriert mit 0.1 mol/l NaOH):
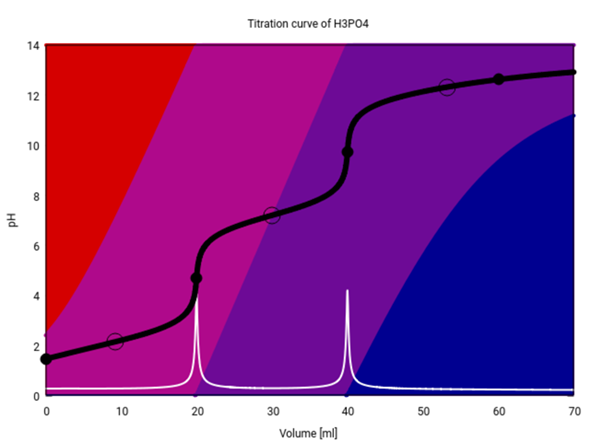
Am Anfang liegt hauptsächlich H₃PO₄ vor (gleich wie oben bei der x-Koordinate 1 ≙ 0.1 mol/l), Rest H₂PO₄⁻. Am ersten Äquivalenzpunkt verschwindet die H₃PO₄, dafür taucht danach erstmals HPO₄²⁻ auf, das aber am 2. ÄP zu 100% vorliegt. Danach macht es Platz für PO₄³⁻, aber es verschwindet nicht vollständig, sondern kommt noch nach dem (unsichtbaren) 3. ÄP vor, weil die Lösung nie basisch genug wird für 100% PO₄³⁻ —dafür würden wir im wesentlichen pH≈14 brauchen.
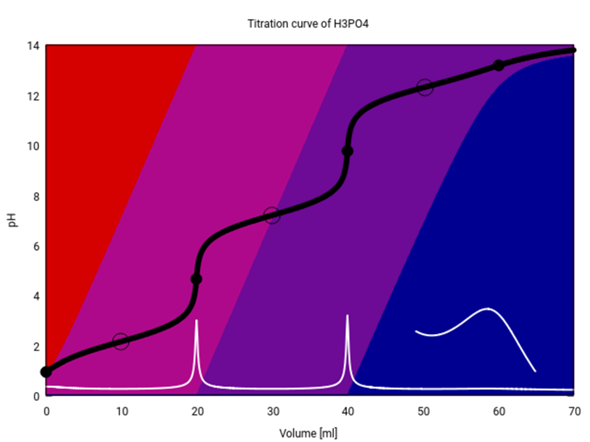
Selbst wenn man mit absurd hohen Konzentrationen titriert, geht es nicht. Hier habe ich dieselbe Titration mit c=10 mol/l für beide Lösungen durchgerechnet (beachte, daß bei so hohen Ionenstärken die Rechnungen nicht sehr verläßlich sind), und da sieht man zwar vom 3. ÄP gerade noch einen Hauch, aber trotzdem kriegt man keine 100% PO₄³⁻ — die Lösung ist einfach nicht basisch genug.
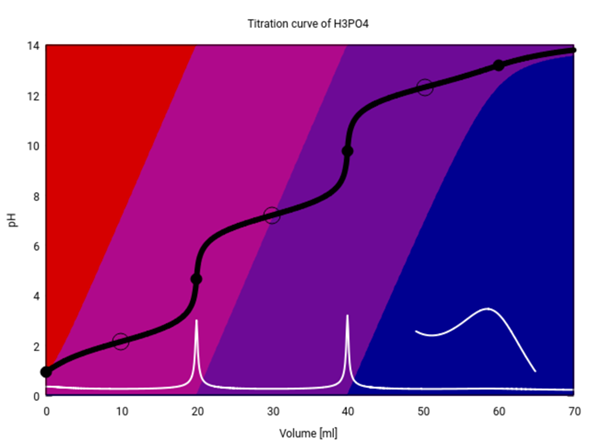
Was meinst Du mit „Schema“? In Wasser bestimmt nicht, das siehst Du ja an der ersten Graphik. Mit NaOH (oder KOH, das ist egal) spielt kannst Du je nach Mengenverhälnis jedes der drei Salze NaH₂PO₄, Na₂HPO₄ oder Na₃PO₄ bekommen.
Letztlich hängt das vom pH Wert hab! Die Protolysestufen sind unterschiedlich stark.
In Wasser wird das 1. Proton praktisch vollständig abgegeben (starke Säure), das 2. unvollständig (schwache Säure) und das 3. erst, wenn man den pH-Wert durch eine zusätzliche Säure wieder künstlich anhebt (sehr schwache Säure).
Dies erkennt man an den sogn. pKs Werten!
Als Säure ist Phorsphorsäure ein sehr schlechtes Ampholyt, obwohl der 4. Sauerstoff ja theoretisch ein 4. Proton aufnehmen könnte! Dazu bräuchte man einen sehr niedrigen pH Wert. Aber schon das 1. Anion wäre ja eins, wie bei jeder mehrprotonigen Säure!
Im unterricht haben wir gesagt sie gibt alle ab unter diesem schema? Kannst du mir das erklären