Protolyse bei H3PO4?
Hi,
wie funktioniert die Protolyse z.b. bei H3PO4, wo es mehr als nur ein H-teilchen gibt. Wäre das dann : H3PO4+H2O -> H2PO4- + H3O+
Mfg
2 Antworten
Moin,
ja, genau. Bei mehrprotonigen Säuren kannst du auch mehrere Protolyseschritte formulieren. Im Falle der dreiprotonigen Phosphorsäure sähe das (formal) dann so aus:
1. Protolyseschritt:
H3PO4 (aq) + H2O (l) ---> H2PO4^– (aq) + H3O^+ (aq)
Eine Phosphorsäurelösung und Wasser reagieren zu Dihydrogenphosphat-Anionen und Oxoniumionen.
2. Protolyseschritt:
H2PO4^– (aq) + H2O (l) ---> HPO4^2– (aq) + H3O^+ (aq)
Dihydrogenphosphat-Anionen und Wasser reagieren zu Hydrogenphosphat-Anionen und Oxoniumionen.
3. Protolyseschritt:
HPO4^2– (aq) + H2O (l) ---> PO4^3– (aq) + H3O^+ (aq)
Hydrogenphosphat-Anionen und Wasser reagieren zu Phosphat-Anionen und Oxoniumionen.
LG von der Waterkant
Du bekommst insgesamt drei Protolyseschritte:
H₃PO₄ + H₂O ⟶ H₂PO₄⁻ + H₃O⁺
H₂PO₄⁻ + H₂O ⟶ HPO₄²⁻ + H₃O⁺
HPO₄²⁻ + H₂O ⟶ PO₄³⁻ + H₃O⁺
Das heißt jetzt aber nicht automatisch, daß vergleichbare Mengen H₃PO₄, H₂PO₄⁻ etc in der Suppe herumschwimmen; welche Dissoziationsstufe zu welchem Ausmaß gebildet wird, hängt von den drei Säurekonstanten ab, und außerdem noch von der Konzentration.

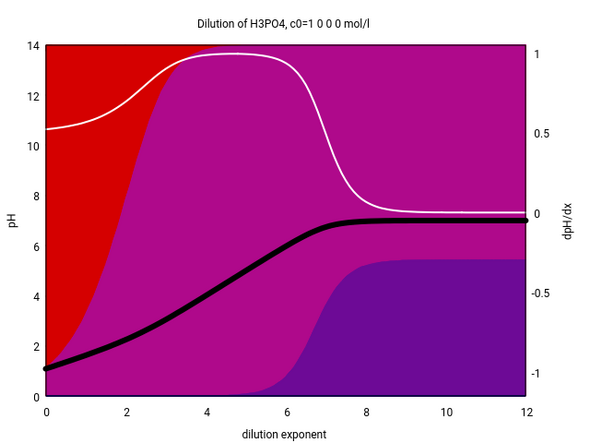
Wenn man es ausrechnet, dann bekommt das das hier gezeigte Bild. Die x-Achse gibt die Konzentration an (4 entspricht 10⁻⁴=0.0001 mol/l Konzentration), die schwarze Kurve zeigt den pH-Wert bei dieser Konzentration und die Hntergrundfarben stehen für die jeweiligen Anteile H₃PO₄ (rot), H₂PO₄⁻ (rotviolett) und HPO₄⁻ (blauviolett).
Du siehst, daß in einer relativ konzentrierten Lösung die meiste Phoshorsäure undissoziiert herumschwimmt, aber unterhalb von 0.001 mol/l liegt fast aller Phosphor als H₂PO₄⁻ vor, und unterhalb von 10⁻⁵ mol/l kommt noch merklich HPO₄²⁻ dazu und steigt bei extremen Verdünnungen (10⁻⁷ mol/l) auf bis zu ca. ⅓ des Gesamtphosphors an.