Chemie Stoffmenge berechnen bei der Aufgabe?
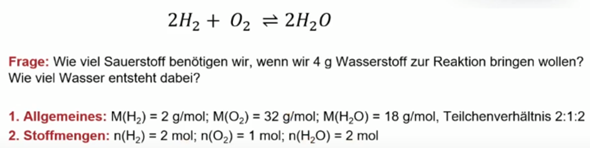
Wie ist man auf die Stoffmenge gekommen? Die Formel lautet ja n=m/M. Bei O2 wäre es ja dann n=4/32*2 oder? Und Bei n(H2O)=4/2*1+16??
Bitte ich blicke gar nicht durch, kann mir das jemand erklären.
3 Antworten
2 H₂ + O₂ ⟶ 2 H₂O
Du hast 4 g H₂, das sind n=m/M=2 mol.
- Aus der Reaktionsgleichung sehen wir, daß wir halb soviel Sauerstoff wie Wasserstoff brauchen. Also nehmen wir ein Mol O₂, das sind m=n⋅M=32 g.
- Außerdem bildet sich Wasser, und zwar gleich viel wie H₂. Also bekommen wir 2 mol H₂O, das sind m=n⋅M=36 g. Alternativ hätten wir auch einfach die Massen des eingesetzten H₂ und O₂ addieren können (4 g + 32 g = 36 g), weil ja außer Wasser nichts entsteht.
Ich rate ja immer dazu mit Formeln und Einheiten zu rechnen....
m(H2)= 4 g
?=n(H2)=m(H2)/M(H2)= 4 g /2 g/mol = 2 mol
2 mol H2 reagieren mit 1 mol O2 zu 2 mol H2O, laut der Reaktionsgleichung und dem Zahlenverhältnis 2:1:2
Also benötigt man 1 mol O2 (= 32 g) und es entstehen 2 mol H2O (2× 18 g = 36 g).
Es ist die einfachste aller Varianten, wo man weder rechnen muss, noch einen Taschenrechner benötigt...nicht sehr schwierig und auch nicht sehr lehrreich.
1 Mol Wasserstoff wiegt 2g. 4g Wasserstoff sind also 2 Mol. Zum Verbrennen von 2 Mol Wasserstoff benötigst Du 1 Mol Sauerstoff (die Zahlen vor dem Formelzeichen / der Formel). Und ein Mol Sauerstoff wiegt 32 g.
Ein Mol eines Stoffes enthält definitionsgemäß genau 6.02214076e²³ Teilchen. Das ist einfach so festgelegt, weiß der Geier, wie das gemacht wurde. Wobei mit Teilchen das Molekül gemeint ist. Und da Wasserstoff und Sauerstoff nicht atomar sondern als Molekül mit 2 Atomen auftreten, ist es eben H2 und nicht H und O2 und nicht O.