Thermodynamik Chemie - freigesetzte Wärmemenge berechnen?
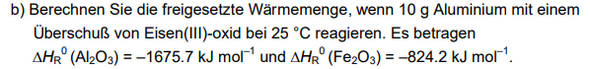
Die Reaktionsgleichung und die Lösung der Aufgabe lauten:
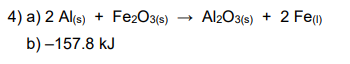
Dass man die Differenz der Enthalpien in Verbindung mit den Stoffmengen bringen muss, habe ich verstanden. Nur in welcher Formel und wie muss ich das Stöchiometrische Verhältnis beachten?
2 Antworten
Ich weiß die Frage ist schon älter, aber falls das nochmal jemand sucht, wollte ich doch noch den Lösungsweg teilen den ich gefunden hab. Weil ich auch erst versucht hab die Lösung im Internet zu finden und mir dann ganz viel zusammensuchen musste anstatt den Weg direkt zu finden.
Ich hab mit der Formel Q= n* delta H gerechnet
Erst die Stoffmenge von Aluminium bestimmen mit n= m/M
Und dann braucht man noch delta H von Aluminium. Es sind 25 Grad Celsius angegeben also hab ich mit der Standartreaktionsenthalpie delta H ausgerechnet. Delta H von R = Die Summe der Standartbildungsenthalpie der Produkte - die Summe der Standartbikdungsenthalpie der Edukte
Ich nehme an das das in der Aufgabenstellung irgendwie ein Druckfehler oder so war das da das r als index steht anstelle eines fs.
Also delta H (Al) = delta H( Al2O3) - delta H ( Fe2O3)/2
weil Al ja 2 mal in der Reaktionsgelichung steht. Keine Ahnung warum man Eisen nicht mit einrechnet, aber ich nehme an sollte man das tun würde in der Aufgabenstellung dafür ein Wert stehen.
Und dann alles in die Gleichung von Q einsetzen.
Hab als Werte n(Al) = 0.3706 mol delta H = -425,75 kJ/mol und Q= -157,8 kJ
Ich bin selber dabei für diesen Kurs noch zu lernen aber ich hoffe mal das das der richtige Weg ist, da ich auf das Lösungsergebnis komme. Und alle in der Aufgabenstellung angegebenen Werte benutzt hab. Und hoffe das hier ist verständlich obwohl ich schrecklich darin bin, Matheformeln mit dem Rechner zu tippen
Hmm, ich verstehe nicht, was der Index R beim ΔH° bedeuten soll. Erwarten würde ich eine Standardbildungsenthapie, aber dann müßte der Index f sein.
Unter der Annahme, es wären Standardbildungsenthalpien: Die Reaktion liefert ein Al₂O₃ und verbraucht ein Fe₂O₃. Die Koeffizienten sind also +1 und −1. Im Prinzip muß man auch noch das Eisen (+2) und das Aluminium (−2) berücksichtigen, aber das sind Elemente, und daher ist die Standardbildungsethalpie Null. Die Reaktionsenthalpie ist also einfach −1675.7 − (−824.2) = −851.5 kJ mol⁻¹