Chemie Reakt.gl. aufstellen - Hilfe!?
Hey Leute,
ich bin total verloren in Chemie und brauche eure Hilfe. Unsere Lehrerin kann nichts erklären und da ich lange nicht da war, habe ich auch nur mangelhafte Infos.
Könnt ihr mir die Aufgaben erklären/vorrechnen?
Alex

2 Antworten
Moin,
schlechte Erklärqualitäten einer Lehrkraft oder Wissenslücken im Stoff sind doch kein Grund, gar nichts selbst zu recherchieren...
Also Aufgabe 1 kannst du zum Beispiel superleicht bei Wikipedia finden (Stichwort „Oxalsäure”)...
Aufgabe 3:
Die Moleküle von Dicarbonsäuren und Hydroxicarbonsäuren bilden beide verhältnismäßig viele Wasserstoffbrückenbindungen untereinander aus, so dass sie sich zu Molekül-Kristallgittern zusammenfinden (wie auch Zucker).
Aminosäuren liegen in der Regel sogar als Zwitterionen vor, die sich folglich zu Ionen-Kristallgittern zusammenlagern (wie Salze).
Beide verfügen über viele hydrophile funktionelle Gruppen (Hydroxy-, Carboxy- oder Aminogruppen), die leicht Wasserstoffbrückenbindungen zu Wassermolekülen ausbilden können. Deshalb sind sie alle gut wasserlöslich. Im Falle der Carbonsäuregruppe kommt noch hinzu, dass sie ein Protonendonator ist, so dass im Wasser (wenigstens) teilweise Carboxylat-Ionen und Oxoniumionen entstehen, was sich ebenfalls gut im Wasser löst.
Aufgabe 4
Das wirst du wieder selbst schaffen, da bin ich mir scher...
Aufgabe 5
Das sind Säure-Base-Reaktionen. Einmal nur an einer Carboxygruppe (was zu Kaliumhydrogentartrat führt) und einmal an beiden...
C4H6O6 + KOH ---> C4H5O6K + H2O
Weinsäure Kaliumhydroxid Kaliumhydrogentartrat Wasser
C4H6O6 + 2 KOH ---> C4H4O6K2 + 2 H2O
Weinsäure Kaliumhydroxid Kaliumtartrat Wasser
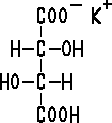
Halbstrukturformel des Kaliumhydrogentartrats. Die Strukturformel sieht ähnlich aus, nur dass du alle OH-Gruppe als –O–H darstellen musst (und die freien Elektronenpaare am Sauerstoff miteinzeichnest, was hier nicht darstellbar ist) und anstelle des COO folgendes malst: O=C–O (und dann entweder die Ladung oder das H an das einzelne O anfügst. Auch hier hat jedes Sauerstoffatom noch zwei frei Elektronenpaare).
Im Falle des Kaliumtartrats sieht das untere COOH wie das obere COO^–K^+ aus.
Den Rest schaffst jetzt allein, nicht wahr?
Aufgabe 7
3 NaHCO3 + H3Cit --[H2O]--> Na3Cit + 3 CO2↑ + 3 H2O
Das Kohlenstoffdioxid entsteht, weil die drei Protonen der Citronensäure auf die Hydrogencarbonat-Anionen übertragen werden. Dabei entsteht dann eigentlich Kohlensäure (H2CO3), aber die ist instabil und zerfällt unter Wasserabspaltung zu Kohlenstoffdioxid (Erlenmeyerregel):
H2CO3 ---------->(<--) H2O + CO2↑
Theoretisch gibt es auch die Rückreaktion, aber da das Kohlenstoffdioxid als Gas ständig den Reaktionsraum verlässt (↑), gibt es die hier nicht.
Die Citronensäure habe ich mit H3Cit abgekürzt. Wenn du die als Strukturformel benutzen willst, verweise ich wieder auf das Internet und bitte um Eigeninitiative...
LG von der Waterkant
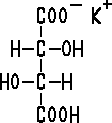
Hallo, zu 1 gehört folgende Reaktionsgleichung(Wikipedia anschauen)
3)polaren Wassermoleküle können sich nur mit anderen polaren Molekülen mischen
5)Kalilauge=KOH
Edukte:C4H6O6 + KOH
7)3 NaHCO3 + C6H8O7 =->>3 CO2 + 3 H2O + Na3C6H5O7
Immer wieder gerne, kannst ruhig nochmal nachfragen wenn du noch Fragen hast
Legendär, danke