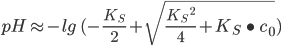Chemie Aufgaben, wie habe ich diese zu lösen?

Da wir heute einen sogenannten Studientag haben und mich diese Aufgaben vor so einige Probleme stellen, wollte ich mal nachfragen, ob hier vielleicht jemand eine Idee hätte, wie ich die Aufgaben 4. 5. 6. zu lösen habe.
2 Antworten

zu 4)
Salzsäure ist eine starke Säure. Man geht also davon aus, dass sie vollständig dissoziiert.
Der pH-Wert ergibt sich folgendermaßen: pH = -log(c(H+))
Wenn man sich die Dissoziationsgleichung von HCl in Wasser anschaut, sieht man, dass c(HCl) = c(H+) sein muss, Stöchiometrie 1:1:
HCl --> H+ + Cl-
Für eine Konzentration c(HCl) = 10 mol/L heißt das dann: pH = -log (10) = -1
Für eine Konzentration c(HCl) = 10^-8 mol/L heißt das dann: pH = -log (10^-8) = 8
zu 5)
Dazu einfach die Formel aus 4 umstellen:
c(HCl) = c(H+) = 10^-pH
= 10^-1,5 = 0,0316 mol/L
zu 6)
Mit einem pKs von 3,77 gilt Ameisensäure als schwache Säure. Für schwache Säuren kann man keine vollständige Dissoziation mehr annehmen. Also können wir nicht wie oben sagen, dass c(HCOOH) = c(H+) ist, sondern müssen den Grad der Dissoziation annähern:
pH = 1/2 * (pKs - log(c(HCOOH)))
Wenn man das umstellt ergibt das:
c(HCOOH) = 10^(pKs - pH/0,5)
10^3,77-1,3/0,5 = 14,791 mol/L = c(HCOOH)


Zu 4)
Salzsäure mit c = 10 mol/L hat den pH-Wert -1. Allerdings hat eine mit der Konzentration 10⁻⁸ mol/L nicht, wie man vielleicht vermuten könnte, den pH-Wert 8. Das liegt daran, dass diese schematische Rechnerei im Bereich um den Neutralpunkt 7 oder gar darüber nicht mehr funktioniert, Je näher man dem Neutralpunkt kommt, um so stärker spielt die Autoprotolyse des Wassers eine Rolle, die ja 10⁻⁷ mol/L an Oxoniumionen liefert. Bei 10⁻⁸ mol/L HCl ist die Oxoniumkonzentration dann c(H3O) = (10⁻⁷ + 10⁻⁸) mol/L. Der negative dekadische Logarithmus liefert den zugehörigen pH-Wert mit 7,96.
Zu 6)
Ameisensäure mit einem pKs von 3,77 gehört nicht zu der Gruppe der schwachen Säuren. Eine Näherungsformel für die Berechnung bei mittelstarken Säuren ist:
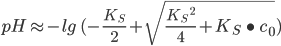
c0 ≈ 14,84 mol/L
Hier muss man allerdings erkennen, dass auch die Näherungsrechnung für schwache Säuren noch ein brauchbares Ergebnis liefert.