Chemie- Titration - Welcher Indikator?
Wir sollen in der Schule ein Titration durchführen mit Ammoniaklösung und Schwefelsäure und die Wahl des Indikators begründen. Welcher Indikator wäre hierbei geeignet und warum?
2 Antworten
Hi,
dabei musst du dir anschauen, was für eine Säure und was für eine Base reagieren, um den Äquivalenzpunkt abschätzen zu können.
Bei Ammoniak und Schwefelsäure werden Ammoniumhydrogensulfat (erste Protolysestufe) und Ammoniumsulfat (zweite Protolysestufe) entstehen.
Allerdings liegt Ammoniumsulfat als Ionen vor, Ammonium selbst wird wohl das Gleichgewicht
NH4(+) + H2O ⇌ NH3 + H3O(+)
bevorzugen. Denn Ammoniak ist eher eine schwache Base und Schwefelsäure eine starke Säure (die also gern dissoziiert bleibt). Das heißt, wir werden auch H3O(+)-Ionen in unserer Lösung haben.
Daraus kann man schlussfolgern (da du eine starke Säure mit einer schwachen Base titrierst), dass der Äquivalenzpunkt im sauren Bereich liegt.
Du brauchst also einen Indikator, der im sauren Bereich umschlägt. Direkt einfallen tut mir da Methylrot.
LG
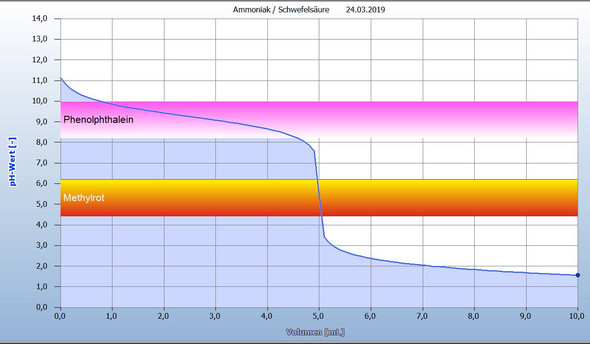
Ich habe Dir eine Titration von Ammoniaklösung mit Schwefelsäure simuliert. In die Grafik habe ich zwei Indikatoren mit den Umschlagsbereichen (siehe pH) eingezeichnet.
Vielleicht kommst Du von selbst auf die Lösung Deiner Frage zur Indikatorwahl.
Ich möchte Deine Frage als Hilfe für Dich ein bißchen umformulieren:
"In welchem pH-Bereich muss der Umschlagspunkt eines Indikators bei der Grafik einer Titrationskurve liegen?"
Gehe zu
www.teachershelper.de/menue-startseite
und lade bei Software AKLabor+AKAnalytik11 herunter.
Der Programmteil AKAnalytik11 kostet zwar, aber mit diesem habe ich die Simulation gemacht.
Wie heißt das Programm, mit dem du das Ganz simuliert hast?
~Johannes