Berechnung Maße Propan?
5g Propan werden verbrannt. Wie berechnet man die Masse und das Volumen des entstehenden Kohlenstoffdioxids
1 Antwort
Als erstes guckst du dir die Reaktionsgleichung der Verbrennung von Propan an:
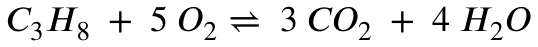
Mit der Molaren Masse von Propan rechnest du aus, wie viel mol 5 Gramm Propan entsprechen:
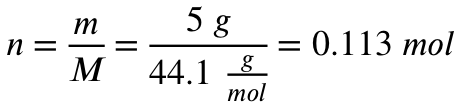
Aus der Reaktionsgleichung wird deutlich, dass pro 1 Propan 3 Kohlenstoffdioxid entstehen. Die Stoffmenge des entstehenden Kohlenstoffdioxid muss also 3 mal so viel sein, wie die Stoffmenge des Propan:
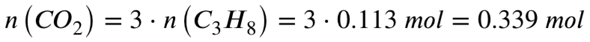
Also entstehen 0,339 mol Kohlenstoffdioxid. Mit der Molaren Masse von Kohlenstoffdioxid rechnest du aus, wie viel Gramm diese 0,339 mol Kohlenstoffdioxid entsprechen:
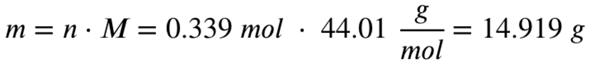
Es entstehen 14,919 Gramm Kohlenstoffdioxid bei der Verbrennung von 5 Gramm Propan.
Jetzt müssen wir noch das Volumen der 0,339 mol Kohlenstoffdioxid ausrechnen. Dazu verwenden wir die ideale Gasgleichung:
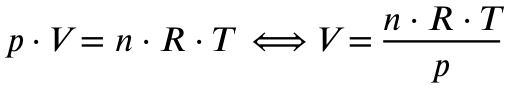
Mit
p = Druck in Pascal (nicht explizit genannt, ich gehe von Normaldruck von 1013 hPa, also 101300 Pa aus)
V = Volumen in Kubikmeter (gesucht)
n = Stoffmenge in mol (errechnet, 0,339 mol)
R = Ideale Gaskonstante (8,314 J/mol*K)
T = Temperatur in Kelvin (nicht explizit genannt, ich gehe von Normaltemperatur von 0 Grad Celsius, also 273,15 K aus)
Einsetzen ergibt jetzt:
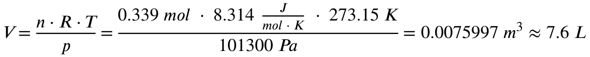
Die 0,339 mol Kohlenstoffdioxid entsprechen unter Normalbedingungen (Druck von 1013 hPa und Temperatur von 273,15 K) 7,6 Liter.
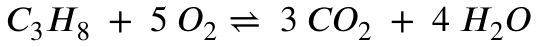
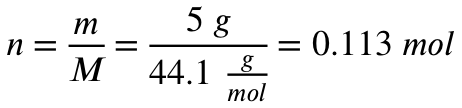
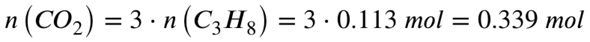
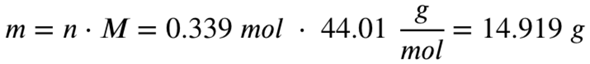
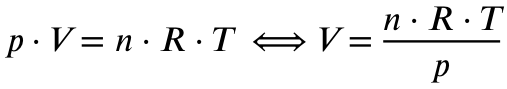
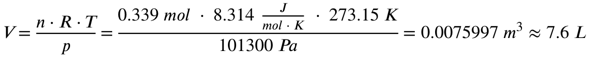
That doesn’t matter, I love biology and chemistry :)))
Was sind die 44,1 g/mol bei der obigen Rechnung ? Wie kamst du auf die Zahl?
44,1 g/mol ist die molare Masse von Propan, 44,01 g/mol ist die molare von Kohlenstoffdioxid. Die kannst du entweder online nachlesen, oder du errechnest sie mit den Massen aus dem PSE
I love biology ! :) danke dir Vielmals