Zerfallsreihe Th bis Nd-144?
Guten Abend,
ich muss für Physik (Oberstufe) eine Ausarbeitung einer Zerfallsreihe machen.
Mein Lehrer hat mir als Ziel-Nuklid Nd-144 gegeben und als Start-Nuklid sollte ich mir entweder ein Th-Nuklid oder U-Nuklid wählen.
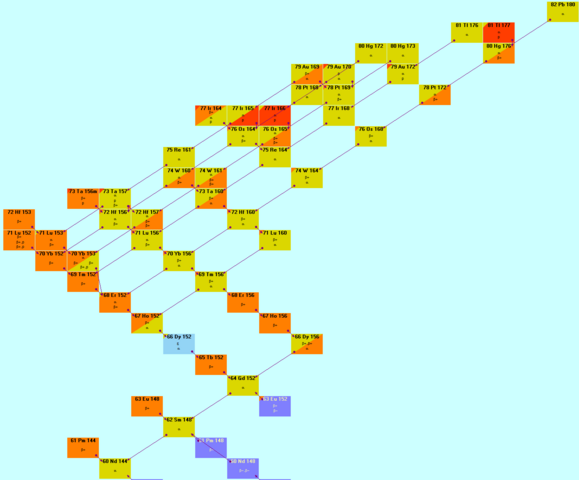
Ich habe einen Th-Nuklid gewählt (Th-209) und bin bis zu Au-197 und Ir-193 gekommen. (siehe Bild)

(Nd-144 liegt um einiges Tiefer.)
Deswegen habe ich eine Software gesucht, die mir alle Möglichkeiten bis zu Nd-144 anzeigt. Hierbei war das "höchste" Start-Nuklid Pb-180. (Blau Markiert auf dem Bild)
Dabei verzweifle ich aber an dem Gedanken, dass man von Th-* zu Pb-180 gelangt, da wortwörtlich nichts "über" diesem Nuklid ist. (Entschuldigt meine Ausdrucksweise, habe nicht wirklich Ahnung)
Die Software hat folgendes ausgespruckt:
Ich hoffe ihr könnt mir helfen, ich wäre sehr dankbar :)
3 Antworten
²⁰⁹Th ist ein reichlich exotisches Isotop, das in der Natur nicht vorkommt und nur ein paar Millisekunden Halbwertszeit hat. Ein ganz schlechter Startpunkt, die relevanten Thorium-Isotope haben Massenzahlen um die 230.
Die Zerfallsketten kannst Du nicht wirklich bis zu so leichten Elementen wie Neodym erweitern, weil die Elemente leichter als Bi im allgemeinen nicht radioaktiv sind, also Endpunkte der Ketten darstellen. Am Endpunkt ist aber Schluß, deshalb enden die drei natürlichen Zerfallsketten, sobald sie auf ein stabiles Blei-Isotop stoßen (was sich nicht wirklich vermeiden läßt).
Du kannst Neodym vermutlich durch Kernspaltung von Thorium gewinnen, aber nicht durch eine Kaskade von α- und β-Zerfällen.
Weder die natürliche Thorium- noch die Uranzerfallsreihe geht über das in der Aufgabe angesagte Neodymnuklid.
Der Ausdruck "Zerfallsreihe" ist deshalb falsch.
Löse die Aufgabe doch einfach von Hand, so schwer ist das nicht. Eine Anleitung für die Isotopentafel findest du z.B. hier:
Du hast selber anscheinend nicht das Grundlegende Problem verstanden:
Ich soll eine Zerfallsreihe von dem Element A zum Element C machen. Dabei zerfällt aber A bis maximal B (um es sehr stark zu vereinfachen).
Wie schon die anderen Antwortgeber gesagt haben, ist dies nicht möglich mit meiner Aufgabenstellung meines Lehrers. (Da hilft mir ein solches Video auch nicht weiter, da ich das schon längst Händisch und auch mit Programmen durchprobiert habe.)