wie erklärt man die Wirkungsweise der Van-der-Waals-Kräfte?
ich habe 2 Abbildungen (siehe Bild), ich soll jeweils anhand der Abbildungen die Wirkungsweise der Van-der-Waals-Kräfte in unpolaren Molekülen erklären
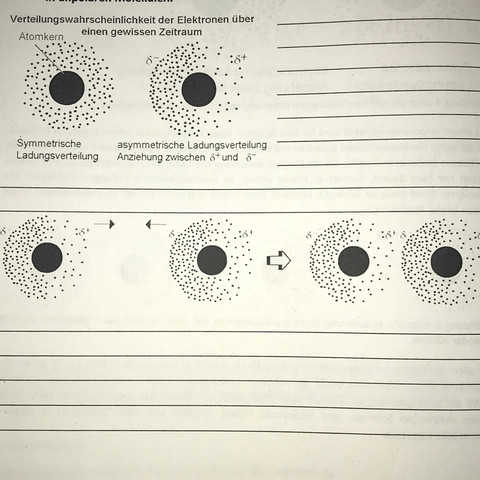
2 Antworten

Moin,
na, die Bilder zeigen es doch ganz gut...
Wenn du davon ausgehst, dass sich Elektronen in der Hülle eines Atoms gleichmäßig verteilen, hast du das erste Bild.
Da die Elektronen aber keine starren Objekte sind, die sich unbeweglich nur an einem Ort aufhalten, kommt es zu gewissen Schwankungen in der Elektronendichte rund um den Atomkern. Dadurch entsteht eine mehr oder weniger stark ausgeprägte asymmetrische Verteilung der Elektronen um den Kern. Dann gibt es in der Elektronenhülle Bereiche, wo sich mehr Elektronen (zufällig) aufhalten. Solche Bereiche sind dann logischerweise etwas negativer teilgeladen als andere Stellen, wo die Elektronendichte in diesem Moment gerade nicht so groß ist. Diese Bereiche sind dann positiv teilgeladen. Das kannst du dir so vorstellen, als würde die Elektronendichte immer so hin- und herschwappen... Einen solchen Moment zeigt Bild zwei.
Tja, und wenn nun ein Atom mit einer solch asymmetrischen Verteilung seiner Elektronendichte in die Nähe eines anderen Atoms kommt, kann es bei diesem Atom eine entsprechende ungleichmäßige Verteilung der Elektronendicht auslösen, weil sich die Elektronen zu dem partiell positiven Bereich in der Elektronenhülle des ersten Atoms hingezogen fühlen. Dadurch wird in dem anderen Atom eine Asymmetrie ausgelöst (induzierter Dipol). Und dann ziehen sich die Atome eben gegenseitig an. Es liegt auf der Hand, dass solche Anziehungskräfte nicht besonders stabil oder groß sind. Aber wenn es über weite Bereiche von Molekülen zu solchen induzierten Wechselwirkungen kommt (= van-der-Waals-Kräfte), dann halten sich die Moleküle eben gegenseitig ein bisschen fest.
Alles klar?
LG von der Waterkant

Verdichtung durch Rütteln.