We viele außenelektronehat kupfer?
Es sagen welche 2 andere 11 und paar 1.Sollte es nicht 1 sein?Oder wie viele sind es
2 Antworten

Moin,
es kommt darauf an, was du unter »Außenelektronen« verstehen willst.
Nach dem Orbitalmodell vom Atombau ist es nämlich so, dass die Hülle von Atomen in sich noch einmal einen Feinaufbau hat.
Und so kommt es, dass die 3. Schale in drei Bereiche untergliedert ist, die energetisch nicht völlig gleichwertig sind.
Dort gibt es Aufenthaltsräume für Elektronen, in denen man die Elektronen mit einem bestimmten Energiegehalt und einer bestimmten Wahrscheinlichkeit antrifft (Aufenthaltswahrscheinlichkeitsraum = Orbital).
Das 3s-Orbital hat eine kugelrunde Gestalt und kann zwei Elektronen aufnehmen.
Die 3p-Orbitale sind hantelförmig (Knotenpunkt ist der Atomkern) und können insgesamt sechs Elektronen aufnehmen.
Und dann gibt es da schließlich noch die fünf 3d-Orbitale. Sie haben unterschiedliche Gestalt (vier sind doppelhantelförmig und ein fünftes ist eine dicke Hantel mit einem Ring um den Knotenpunkt):
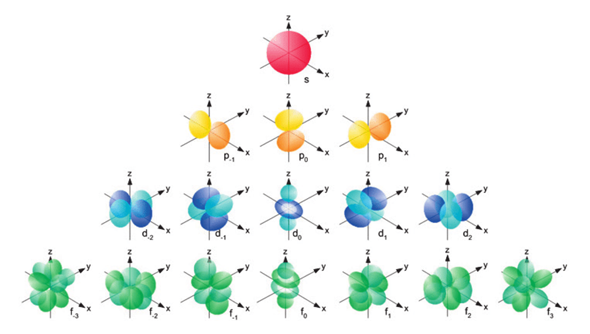
Doch von der Energie her gesehen ist das s-Orbital der nächsten (der 4.) Schale etwas günstiger (energieärmer) als die 3d-Orbitale.
Nach der Energieregel zur Besetzung von Orbitalen müsste daher eigentlich das 4s-Ornital zuerst doppelt mit Elektronen besetzt werden, bevor die 3d-Orbitale Elektronen erhalten.
Das heißt, dass sich die 29 Elektronen von Kupferatomen wie folgt verteilen müssten:
1s2, 2s2 2p6, 3s2 3p6 3d9, 4s2
(zwei Elektronen im 1s-Orbital, zwei Elektronen im 2s-Orbital, sechs Elektronen in den drei 2p-Orbitalen...)
Hier hätte also Kupfer (formal) zwei Außenelektronen, nämlich die beiden im 4s-Orbital, das formal zur vierten Schale gehört (obwohl es energetisch weiter innen liegt als die 3d-Orbitale).
Aber neben der Energieregel zur Besetzung von Orbitalen mit Elektronen gibt es auch noch die Regel der voll- und halbvollbesetzten Orbitale. Sie besagt etwa, dass vollbesetzte und halbvollbesetzte Orbitale vorzuziehen sind vor vollbesetzten und irgendwie besetzten Orbitalen.
In dem oben genannten Fall wäre das 4s-Orbital voll besetzt (dort passen maximal zwei Elektronen hinein). Die 3d-Orbitale wären dagegen mit 9 Elektronen „irgendwie” besetzt (denn hier passen maximal zehn Elektronen hinein).
Wenn du die Orbitale dagegen folgendermaßen besetzen würdest
1s2, 2s2 2p6, 3s2 3p6 3d10, 4s1
dann wäre die 3d-Orbitale voll besetzt und das 4s-Orbital immerhin halbvoll besetzt. Das ist energetisch günstiger als das vollbesetzte 4s-Orbital und die „irgendwie” besetzten 3d-Orbitale.
In diesem Falle hätten Kupferatome (formal) ein Außenelektron, weil das formal zur äußersten vierten Schale gehörende 4s-Orbital nur mit einem Elektron besetzt wäre.
Die Regel der voll- und halbvollbesetzten Orbitale kommt allerdings nur zum Tragen, wenn der Energieunterschied zwischen den betrachteten Orbitalen nicht allzu groß ist. Das wäre zum Beispiel bei den 3d-Orbitalen und dem 4s-Orbital gerade so der Fall. Deshalb ist die zweite Auffüllung der Orbitale mit Elektronen von Kupferatomen im Grundzustand (energieärmster Zustand) auch korrekter als die erstgenannte Möglichkeit.
Aber gerade weil der Energieunterschied zwischen den 3d-Orbitalen und dem 4s-Orbital nicht allzu groß ist, könntest du auch auf die Idee kommen zu sagen, dass alle Elektronen aus den 3d-Orbitalen und dem 4s-Orbital die Außenelektronen sind. Dann hätten Kupferatome elf Außenelektronen (9 3d + 2 4s bzw. 10 3d + 1 4s).
Und jetzt wird auch verständlicher, warum das Nebengruppenelement Kupfer bevorzugt einfach positiv bzw. zweifach positiv geladene Ionen bildet (Cu+ bzw. Cu2+), denn die Abgabe des Elektrons aus dem 4s-Orbital im Grundzustand führt zu einfach positiv geladenen Kupferionen (Cu+), wobei durch die Zuführung von Aktivierungsenergie bereits schnell der angeregtere Zustand mit der Verteilung
1s2, 2s2 2p6, 3s2 3p6 3d9, 4s2
erreicht werden kann, so dass dann die beiden Elektronen aus dem 4s-Orbital abgegeben würden, so dass es zu Bildung von zweifach positiv geladenen Ionen käme (Cu2+).
Wie gesagt, es kommt darauf an, was du als Außenelektron sehen willst. Ich hoffe, dass der kleine Ausflug in das Orbitalmodell des Atombaus die verschiedenen Sichtweisen deutlich werden ließ.
LG von der Waterkant

11 sind es
