Warum wird die maximale Wärmemenge bei einem reversiblem Schritt aufgenommen?
Bei einem irreversiblem Schritt nimmt die Entropie gemäss Clausius Ungleichung ja mehr zu als bei einem reversiblem. Nach meinem Verständnis nimmt die Entropie nur durch Wärmeaufnahme zu, wie steigt die Entropie dann weiter? Wird mehr Wärme aufgenommen?
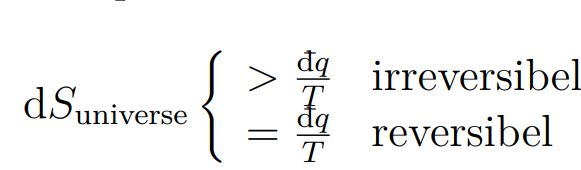
Falls das so wäre, dann müsste z.b. bei einer isothermen Expansion (innere Energie konstant) die Arbeit kleiner sein um die grössere wärmemenge zu kompensieren.
Nach Skript ist jedoch sowohl die aufgenommene Wärme und auch die Arbeit kleiner als beim reversiblen Schritt.
Wieso?
1 Antwort
Bei einem irreversiblem Schritt nimmt die Entropie gemäss Clausius Ungleichung ja mehr zu als bei einem reversiblem.
Das ist korrekt.
Nach meinem Verständnis nimmt die Entropie nur durch Wärmeaufnahme zu,
Das ist der Denkfehler. Ein reversibler Vorgang ist eine rein theoretische Vorstellung, den es in Wirklichkeit nie gibt, mit dem sich aber einfach rechnen lässt. Ein reversibler Vorgang hätte als Bedingung, dass der Wärmeübergang bei der Temperaturdifferenz 0 erfolgt, womit man eine unendlich große Wärmetauscherfläche bräuchte, es dürften keinerlei innnere Verwirbelungen oder mechanische Reibung auftreten, denn jede innere und äußere Reibung erzeugt Entropie und letztlich müsste der Prozess unendlich langsam ablaufen, womit er unendlich lange dauern würde.
Falls das so wäre, dann müsste z.b. bei einer isothermen Expansion (innere Energie konstant) die Arbeit kleiner sein
So ist es. Bei einem reversible Prozess wird ein Teil der inneren Energie, die Arbeit verrichten könnte (= Exergie) in Anergie (Wärme, Energieabfall) umgewandelt. Damit steigt die Temperatur und die Entropie gegenüber einer reversiblen Expansion und die Arbeit wird dafür kleiner. Der Teil an Arbeitsfähigkeit, der in Wärme umgewandelt wird, muss schon nicht mehr von Außen zugeführt werden, um isothermisch zu bleiben.
Nur nebenbei: an einer Drossel findet eine maximal irreversible isotherme Expansion eines Gases statt. Da wird die gesamte Arbeitsfähigkeit der inneren Energie (siehe Carnotwirkungsgrad) durch innere Reibung (Verwirbelungen) in Wärme umgewandelt, sodass die Expansion isotherm erfolgt, obwohl von Außen überhaupt keine Wärme zugeführt wird.