Warum kommt da so ein Pfeil hin?(Chemie)?
Hallo, kann mir jemand erklären warum da so ein Pfeil bei Essigsäure und bei Salzsäure was anderes ist ?
Kann mir das bitte jemand ausführlich erklären und wie ich es erkennen kann?
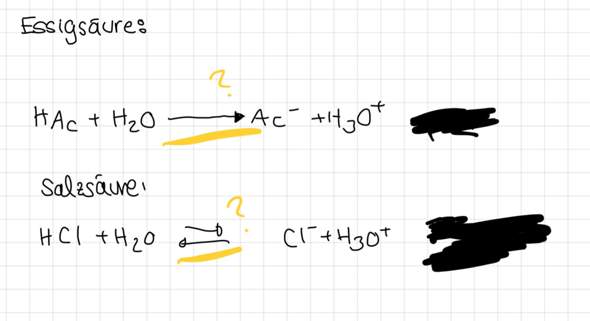
2 Antworten
Moin,
warum du das so aufgeschrieben hast, weiß ich nicht, aber es ist... sagen wir mal nicht ganz korrekt.
„HAc” ist die Abkürzung für Ethansäure (Essigsäure). Essigsäure ist eine schwache Säure. Schwache Säuren dissoziieren in Wasser nicht vollständig. Hin und wieder gibt ein Essigsäuremolekül sein Proton an ein Wassermolekül ab und bildet dabei ein Oxoniumion (H3O^+). Zurück bleibt dann als Säurerest das Acetat-Ion (Ac^–).
Aber wenn das passiert, gibt es irgendwo anders im Reaktionsraum die umgekehrte Reaktion: ein Acetatrest erhält von einem Oxoniumion ein Proton, so dass wieder ein Wassermolekül und ein Molekül Essigsäure resultieren.
Daher stellt sich irgendwann ein chemisches Gleichgewicht zwischen der Protolyse von der Essigsäure und dem Wasser (Hinreaktion) und der Protolyse zwischen dem Oxoniumion und dem Acetatrest ein (Rückreaktion).
Darum verwendet man hier den Gleichgewichtsdoppelpfeil (und nicht den einfachen Reaktionspfeil wie du es getan hast).
Anders sieht das bei der Salzsäure aus. Das Hydrogenchlorid-Molekül (Chlorwasserstoff; HCl) bildet in Wasser eine salzsaure Lösung (Salzsäure). Salzsäure ist - im Gegensatz zur Essigsäure - eine starke Säure. Das bedeutet, dass alle Chlorwasserstoffmoleküle im Wasser vollständig deprotonieren (jedenfalls solange die Wassermoleküle deutlich in der Überzahl sind). Gleichzeitig sind die entstehenden Chlorid-Ionen (Cl^–) nicht bereit, ein Proton von den Oxoniumionen wieder zu übernehmen. Somit passt hier der einfache Reaktionspfeil viel besser.
Fazit:
HCl + H2O ---> H3O^+ + Cl^–
aber
HAc + H2O ---><--- H3O^+ + Ac^–
Du erkennst an den Werten der Säurestärke (pKs-Werte), ob du besser einen Gleichgewichtspfeil oder einen einfachen Reaktionspfeil verwenden solltest.
LG von der Waterkant
Schau doch mal unter dem Stichwort „Säurestärke” nach.
Die pKs-Werte geben an, wie stark eine Säure ist. Grob gilt dabei etwa:
- pKs < 0: starke Säure
- pKs 0 bis 3,5: mittelstarke Säure
- pKs 3,5 bis 7: schwache Säure
- pKs >7: sehr schwache Säure
Und wenn du nun zum Beispiel den pKs-Wert von –1,32 für Salpetersäure (HNO3) findest, weißt du, dass dies eine relativ starke Säure ist. Daher liegen hier so gut wie alle Moleküle vollständig deprotoniert vor, so dass du besser einen einfachen Reaktionspfeil benutzt.
Der pKs-Wert von Phosphorsäure (H3PO4) beträgt 2,13. Somit ist Phosphorsäure eine mittelstarke Säure. Hier könntest du einen längeren Pfeil in Richtung Deprotonierung und einen kürzeren Rückpfeil benutzen, etwa so:
H3PO4 + H2O ------><-- H2PO4^– + H3O^+
Die Essigsäure hat dagegen einen pKs-Wert von 4,76. Sie gehört also zu den schwächeren Säuren. Hier solltest du das folgendermaßen schreiben:
CH3–COOH + H2O ---><----- CH3–COO^– + H3O^+
Verstehst du?
Die pKs-Werte von gängigen Säuren findest du im Internet oder in Formelsammlungen.
Hallo, Marie,
ich habe deine Freundschaftsanfrage erhalten, aber sei mir bitte nicht böse, ich lehne solche Freundschaftsanfragen immer ab, weil ich darin für mich keinen Sinn sehe. Es liegt also nicht an dir, sondern ausschließlich an mir.
Wenn du eine Chemiefrage hast, stell sie einfach so. Mal schauen, was wir dann machen können...
LG von der Waterkant
Hi. Der erste Pfeil heißt sozusagen „reagiert zu“, ergo die Reaktion geht nur in eine Richtung.
Der zweite Pfeil zeigt an, dass die Reaktion in beide Richtungen verläuft
Starke Säuren geben ihr Proton immer vollständig an die schwächere Säure ab (z.B. HCl), dann schreibt man einen einfachen Pfeil; wenn zwei eher schwache Säuren miteinander reagieren, dann wird das Proton nicht vollständig abgegeben und man schreibt den Gleichgewichtspfeil. In der Schule muss man nicht herleiten können, warum das so ist, man sollte nur die klassischen Beispiele für starke und schwache Säuren kennen: stark: Salzsäure, Schwefelsäure, Salpetersäure; schwach: Essigsäure und andere Carbonsäuren
,,Du erkennst an den Werten der Säurestärke (pKs-Werte), ob du besser einen Gleichgewichtspfeil oder einen einfachen Reaktionspfeil verwenden solltest.‘‘
Wie denn ? An welchen Werten?