Protolyse Von Phophorsäure in Wasser?
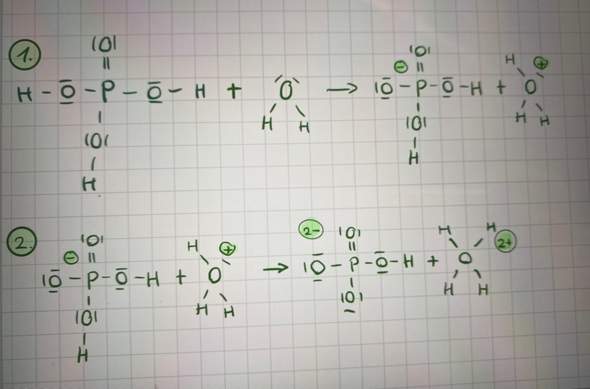
Ich habe eine Frage zur Protolyse Von Phophorsäure in Wasser. Ich verstehe nicht, wie ich nun in einem dritten Schritt das letzte H von der Phosphorsäure mit ans Wasser hängen kann weil es ja kein freies Elektronenpaar mehr gibt.
Oder habe ich vorher schon etwas falsch gemacht?
2 Antworten
Die Lösung ist es, für jeden Protolyseschritt ein neues H₂O-Molekül zu verwenden und zu H₃O⁺ zu protonieren. Denn Dein behauptetes H₄O²⁺ ist ein sehr exotisches Teilchen, das es zwar möglicherweise wirklich gibt, aber ganz sicher nicht in wäßriger Lösung — selbst in Supersäuren (HF + SbF₅) liegt wenn überhaupt nur so wenig davon vor, daß man bis heute nur indirekte Hinweise auf seine mögliche Existenz hat.
H₃PO₄ + H₂O ⟶ H₂PO₄⁻ + H₃O⁺
H₂PO₄⁻ + H₂O ⟶ HPO₄²⁻ + H₃O⁺
HPO₄²⁻ + H₂O ⟶ PO₄³⁻ + H₃O⁺
Dabei ist die erste Reaktion realistisch (sie tritt in Phosphorsäurelösungen aller Konzentrationen in merklichem Umfang auf), die zweite beobachtest Du aber nur in sehr verdünnten (≈10⁻⁷ mol/l) Lösungen, und die dritte tritt niemals auf — natürlich kann man H₃PO₄ bis zum PO₄³⁻ deprotonieren, aber nicht mit Wasser als Reaktionspartner, sondern mit einer stärkeren Base wie OH⁻.
Bei jeder Protolyse wird ein neues H2O Molekül verwendet. Es kann maximal zu H3O+ werden, dann hat es fertig reagiert. Im nächsten Schritt kommt wieder ein neues H2O Molekül. Und dann halt so weiter, bis alle H von der Säure abgespalten sind.