Oxidation von Lithium (Redoxreaktion)?
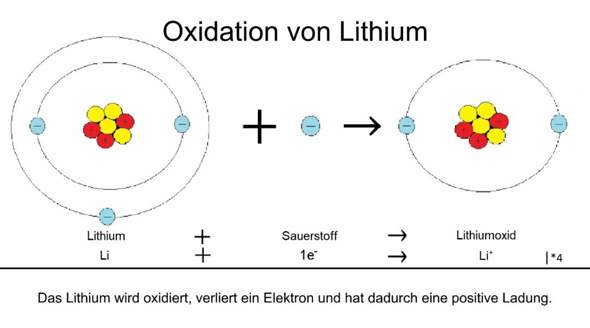
Hey, ist das so wie abgebildet richtig? Wenn nein, schreibt mir bitte genau was falsch ist.
1 Antwort
Nein, es ist falsch. Richtig ist; Li - e⁻ --> Li⁺ oder Li --> Li⁺ + e⁻
Wenn Lithium oxidiert wird, gibt es ein Elektron ab. Dann hat es in der oxidierten Form ein Elektron weniger und ist ein einfach positiv geladenes Kation.
Deshalb muss in der Graphik mit den Atommodellen ein Minus stehen.
Sag mal, feleti8233, du verstehst wirklich nicht viel von dem Thema, was? Picus48 hat dir in beiden Antworten das Richtige geschrieben.
Schau dir doch mal deine eigene Abbildung genau an! Vergleiche vor allem Bild und Text miteinander.
Du hast im Bild links ein Lithiumatom. Es hat im Kern 3 positiv geladene Protonen (rote Kreise mit einem Plussymbol). Außerdem befinden sich im Kern noch 4 ungeladene Neutronen (gelbe Kreise ohne Symbol). In der Hülle befinden sich dagegen 3 Elektronen (blaue Kreise mit einem Minussymbol).
Die drei positiven Ladungen im Kern werden durch die drei negativen Ladungen der Elektronen in der Atomhülle in ihrer Wirkung ausgeglichen (kompensiert). Deshalb ist ein LithiumATOM insgesamt ungeladen.
Nun wird ein Teilchen (wie zum Beispiel dieses Lithiumatom) oxidiert, wenn es mindestens ein Elektron ABGIBT! Und genau das steht in deiner Abbildung auch ganz unten (unter dem Strich): »Das Lithium wird oxidiert, verliert ein Elektron...«
Aber in deinem Bild ist zu sehen, dass zwischen dem Lithiumatom und dem einzelnen Elektron ein „+” steht. Das muss falsch sein, denn das würde doch bedeuten, dass zu dem ungeladenen Lithiumatom ein Elektron hinzu kommt. Aber das entspräche nicht der Abgabe eines Elektrons, sondern einer Aufnahme desselben, kapiert? Wenn aber ein ungeladenes Lithiumatom ein Elektron aufnehmen würde, dann müsste ein negativ geladenes Lithium-Ion entstehen, denn immerhin würde das Lithiumatom doch mit dem Elektron einen negativen Ladungsträger aufnehmen.
In der zweiten Textzeile steht jedoch »Li + 1e- ---> Li+...«. Du siehst jetzt (endlich) hoffentlich selbst ein, dass dies Quatsch sein muss. Denn hier stimmt die Ladungsbilanz nicht: links hast du ein ungeladenes Lithiumatom und ein einzelnes negativ geladenes Elektron, also insgesamt eine Minusladung, rechts hast du plötzlich nur noch ein einfach positiv geladenes Lithiumkation, also insgesamt eine Plusladung...
Und nun kannst du bestimmt auch erkennen, dass bereits dein Bild blödsinnig ist, denn dort wird behauptet, dass ein Lithiumatom + 1 Elektron zu einem Lithiumteilchen werden, dass nur noch zwei Elektronen in seiner Hülle hat (das ist deutlich zu sehen, oder?). Das bedeutet, dass links vom Reaktionspfeil insgesamt vier Elektronen vorhanden sind (drei im Lithiumatom plus ein freies), während es rechts vom Reaktionspfeil nur noch zwei Elektronen gibt. Wo, bitte schön, sind die beiden Elektronen hin??
Darum schrieb Picus48 völlig richtig, dass du entweder
Li – 1e- ---> Li+
schreiben sollst (was allerdings eine ungewöhnliche Schreibweise wäre), weil damit gesagt würde, dass ein ungeladenes Lithiumatom durch die Abgabe eines Elektrons (– 1e-) zu einem einfach positiv geladenen Lithiumkation (Li+) wird oder (noch besser):
Li ---> Li+ + 1e-
In dieser letzten Schreibweise erreichst du nämlich genau die Aussage, die bei der Oxidation eines Lithiumatoms passiert: Das ungeladene Atom wird zu einem einfach positiv geladenen Lithiumkation, indem es ein Elektron abgibt. Deshalb steht nun rechts vom Reaktionspfeil Li+ und 1e-, verstehst du?!
Trotzdem stimmt auch die Aussage, dass bei der Oxidation von Lithium mit Sauerstoff aus Lithium und Sauerstoff Lithiumoxid wird (Antwort auf deinen Post davor). Denn die Antwort hier schließt doch die Antwort auf den Post davor nicht aus, so dass ich deine Nachfrage an Picus48 nicht nachvollziehen kann, außer wenn ich annehme, dass du rein gar nichts vom Thema verstehst und auch nicht in der Lage bist, dir das genau anzuschauen und entsprechende Schlussfolgerungen daraus zu ziehen.
Zum Schluss noch dieser Hinweis: Das Reaktionsschema dieser Reaktion sieht übrigens so aus:
4 Li + O2 ---> 2 Li2O
Die Einzelprozesse dabei sind:
Oxidationsteilgleichung: Li ---> Li+ + e- I•4
Reduktionsteilgleichung: O2 + 4 e- ---> 2 O^2–
--------------------------------------------------------------------------
Redoxgleichung: 4 Li + O2 ---> 4 Li+ + 2 O^2–
Jetzt siehst du nämlich, warum ganz hinten in deinem Text zu deinem Bild dieses „I•4” steht, denn du brauchst insgesamt vier Elektronen, die aus vier Lithiumatomen stammen, um aus einem Sauerstoffminimolekül (O2) zwei Oxidanionen (O^2–) zu machen.
Hast du es jetzt verstanden??
LG von der Waterkant
Ich denke ich habe es jetzt verstanden. DANKE!
Hattest du nicht vor ein paar Stunden noch gesagt: "Richtig ist: Lithium + Sauerstoff --> Lithiumoxid"?