Molekül hier polar oder apolar.?
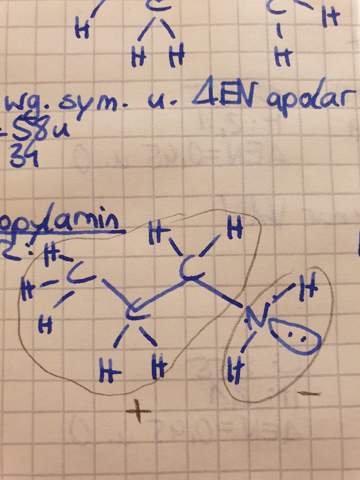
Ist n Propylamin polar oder nicht? Ich denke schon, weil die Wasserstoffbrücken und die Elektronegativitätsdifferenzen auf einer Seite sehr ausgeprägt sind und so dort ein Minispol entsteht. Oder?
3 Antworten
Hatten wir das nicht gestern schon?
ALLE Amine sind polar! Die Bindungen sind polar, die Umgebung des StickstoffAtoms trigonal-pyramidal UND es besitzt ein freies Elektronenpaar, welches (schwache) Wasserstoffbrücken ausbilden kann (nicht hat!).
Ich würde auch nicht sagen, dass dort der/ein MinusPol ist (das könnte man zu leicht mit einer ganzen negativen Ladung verwechseln), sondern sagen, dass dort der negative Ladungsschwerpunkt ist, wobei es in diesem Fall ja nur eine negative Partialladung ist!
emm, VSEPR ist ein ErklärungsModell und wird in der Schule als EPA bezeichnet und eigentlich keine bestimmte Art Formeln zu zeichnen.
Ich würde sagen, dass Du eine perspektivische Lewis-Formel gezeichnet hast, was nicht untypisch ist. Einer speziellen Formel-Konvention entspricht es aber nicht. Für 3D-Moleküle würde man offiziell Keil-Strich-Formeln nehmen!
Also habe ich richtig gedacht und gezeichnet. Langsam verstehe ich es.
Meiner Meinung nach sollte das δ⁻ beim N und das δ⁺ beiden beiden H liegen — der Rest des Moleküls ist unpolar und trägt daher auch keine Partialladungen.
Ja schon. Nur ich wollte das - im grossen Ganzen lokalisieren.
Die Aminogruppe ist polar, aber hier entsteht kein richtiger Minuspol. Wasserstoff und Stickstoff besitzen Partialladungen, eben aufgrund der Elektronegativitätsdifferenz. Da der Alkylrest nicht alzu lang ist überwiegt eher die polare Eigenschaft. Das sieht man an der guten Wasserlöslichkeit des Moleküls.
Ist das Molekül hier in VSEPR geschrieben? Ja, oder?