Katode und Anode, Oxidation und Reduktion?
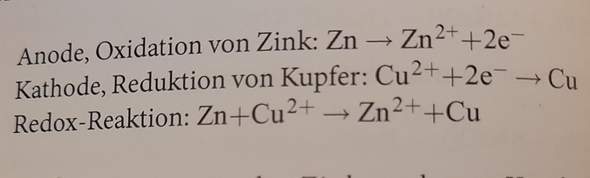
Warum findet die Oxidation bei der Anode statt, wenn diese Elektrode eigentlich nur Elektronen aufnimmt? In diesem Fall werden ja aber Elektronen abgegebenm
Analog bei Kathode: Warum werden dort Elektronen aufgenommen, wenn diese Elektrode eigentlich sie abgegeben?
3 Antworten
Die Anode nimmt Elektronen auf. Diese Elektronen müssen aber von irgendwo kommen, also müssen sie irgendjemandem weggenommen werden, und dieser Irgendjemand wird dabei oxidiert.
An der Kathode ist es natürlich genau umgekehrt: Die wirft Elektronen ins Volk, und dort wo die Elektronen ankommen, wird irgendetwas reduziert.
Diese Erklärung war jetzt auf die Elektrolyse gemünzt. Wenn sich Deine Frage auf ein galvanisches Element bezieht, dann lautet die Antwort einen Hauch anders: Irgendwo läuft eine Reduktionsreaktion ab, dazu werden Elektronen gebraucht, und diese Elektronen werden der Elektrode geklaut. Diese Elektrode heißt dann wieder Kathode, weil sie ja Elektronen abgibt (wenn auch nicht freiwillig, wie im Fall der Elektrolyse). Und bei der Anode ist es umgekehrt: Der werden die Elektronen, die bei einer Oxidationsreaktion freiwerden, aufs Aug gedrückt.
Wenn Du das verstanden hast, dann solltest Du auch nachvollziehen können, daß die Anode bei der Elektrolyse der Pluspol, beim galvanischen Element aber der Minuspol ist.
Du musst dir darüber im klaren sein, dass Anode und Kathode nicht in dem Sinne an der Reaktion beteiligt sind, wie du es dir gerade denken magst.
Kathode und Anode sind Bezeichnungen für zwei verschiedene Orte an denen elektrochemische Reaktionen ablaufen.
Dabei wird immer an der Anode oxidiert, dort werden Elektronen frei, die über einen Leiter, der Anode und Kathode miteinander verbindet, zur Kathode transportiert werden.
Die an der Kathode überschüssigen Elektronen, die durch die Oxidation frei wurden und dorthin gelangt sind, können dann dort verwendet werden, um andere Atome zu reduzieren.
Auch wenn sich Anoden und Kathoden (allg. Elektroden) mit der Zeit abnutzen, ist der Grund dafür jedoch nicht, dass die Elektroden in dem Sinne an der Reaktion beteiligt sind, als dass sie selbst an der Reaktion aktiv teilnehmen und selber oxidiert oder reduziert werden. Die Elektroden bei einer elektrochemischen Reaktion sind im Allgemeinen nur Mittel zum Zweck.
Wichtig ist einfach nur, dass du dir merkst, dass an der Anode die Oxidation stattfindet, und an der Kathode die Reduktion. Voraussetzung dafür ist, dass die beiden Elektroden miteinander verbunden sind, sodass die bei der Oxidation freiwerdenden Elektronen zur Kathode transportiert werden können und dort für die Reduktion genutzt werden können.
Die Voraussetzung dafür, dass die elektrochemische Reaktion stattfinden kann ist, dass die wässrige Lösung in der sich die Elektroden befinden die Ionen der beiden Metalle enthalten.
An der Anode werden Metallatome aus der Elektrode oxidiert, die entstehenden Ionen gehen in Lösung. Die Elektronen wandern zu Kathode. An der werden die Metallionen aus der Lösung reduziert, nehmen also die Elektronen auf und scheiden sich als Metallatome an der Elektrode ab.
Das gilt jedoch nur für Metalle. Bei Halogenen oder Wasserstoff und Sauerstoff oder bestimmten Anionen ist das etwas komplexer und gilt nicht zwangsläufig so.
Es ist letztlich die Definition der Begriffe:
Oxidation = ElektronenAbgabe
Reduktion = ElektronenAufnahme
Anode = Elektrode der Oxidation
Kathode = Elektrode der Reduktion
Also stimmt es nicht, dass bei Anoden Elektronen aufgenommen werden, sondern nur abgegeben werden?
Nicht die Elektroden werden oxidiert, oder reduziert, sondern die Stoffe.
Aber Elektroden bestehen doch aus deisen Stoffen oder nicht?
Also nur die Atome der Ummantelung der Anoden bzw. Kathoden werden oxidiert bzw. reduziert?