Gibt es ZrCl2?
Gibt es ZrCl2 in welchem das Zirkonium nur 2 e- liefert und seine D-Schale leert?
Anstatt weiter runter geht und auch seine 5s Schale leert und zu ZrCl4 geht?
2 Antworten

ZrCl₂ ist ein schwarzer Festkörper, der bei 650 °C zu Zr+ZrCl₄ disproportioniert.
Ich zitiere aus dem Holleman–Wiberg (103. Aufl.):
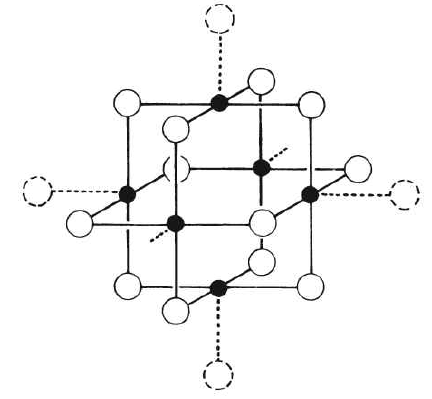
Das Chlorid, Bromid und Iodid des Zirconiums (möglicherweise auch des Hafniums) bilden Hexamere Zr₆X₁₂, in welchen die 6 Zr-Atome gemäß Abb. 25.7b die Ecken eines Oktaeders und die 12 X-Atome die Plätze über den Oktaederkanten besetzen (»ZrI₂-Struktur«). Die Zr₆X₁₂-Cluster sind dabei so angeordnet, dass jeweils X-Atome benachbarter Zr₆X₁₂-Einheiten durch Addition die Koordinationszahl der Zr-Atome auf Fünf erhöhen (quadratisch-pyramidale Zr-Umgebung). Allerdings sind die Zr₆-Oktaeder durch Fremdatome Z wie H, Br, B, C, N Cr, Mn, Fe, Co zentriert, sodass die wahren Formeln der Dihalogenide Zr₆X₁₂Z lauten (die reinen Phasen mit Z = Nichtmetall sind dunkelorangefarben bis rot, mit Z = Metall grün bis blau, die schwarzen Produkte stellen Gemische dar). In Zr₆Cl₁₅ sind (leere) Zr₆Cl₁₂³⁺-Einheiten mit der Oxidationsstufe +1½ der Zr-Atome über jeweils 6⁄2 Cl⁻-Ionen verbrückt; in (leerem) Zr₆Cl₁₂(PMe₂Ph)6 bzw. (leerem) [Zr₆X₁₈H₅]³⁻ (X = Cl, Br) mit den Oxidationsstufen +2.0 bzw. ca. 1.7 der Zr-Atome sind andererseits die 6 Zr⋅⋅X-Gruppen in (Abb. 25.7b) durch Zr—PR₃- bzw. ZrX-Gruppen ersetzt (die Protonen letzterer Anionen überkappen Flächen des Zr₆-Oktaeders).
Den letzten Satz verstehe ich auch nicht so recht.

Noch eine Bemerkung zu etwas, was Du in Deiner Frage scheibst: Zr²⁺ hat ziemlich sicher eine 4d²-Konfiguation mit leerem 5s. Ich habe nicht nachgeschlagen um es zu verifizieren, aber bei Ti²⁺ ist es definitiv so. Kationen der Übergangsmetalle leeren zunächst mal das äußerste s und greifen erst dann die d-Elektronen an, deshalb hat z.B. Fe²⁺ eine d⁶-Konfiguration und Fe³⁺ eine d⁵ (das neutrale Fe hat 3d⁶ 4s²). Wenn Du wissen willst, warum das so ist, dann stell eine neue Frage (Achtung, Quantenmechanik).
Ungepaarte d-Elektronen sind bei Übergangsmetallen häufig und kein Grund zur Besorgnis. Etliche stinknormale Kationen haben eine ungerade Anzahl von d-Elektronen, z.B. d¹ (Ti³⁺, V⁴⁺), d³ (V³⁺), d⁵ (Mn²⁺, Fe³⁺), d⁷ (Co²⁺), d⁹ (Cu²⁺). Ungepaarte Elektronen sind tatsächlich problematisch in den Hauptgruppen und auch bei kovalenten Verbindungen der Übergangsmetalle (Oxide und Halogenide in hohen Oxidationszahlen und spezielle Komplexverbindungen wie Carbonyle), aber bei diesen größtenteils ionischen Vögeln mit wenig kovalenten Bindungsanteilen kan man die ungepaarten Elektronen sehr gut auf die d-Orbitale verteilen (es hilft, daß es so viele davon gibt und daß sie näherungsweise entartet sind). In vielen 3d-Übergangsmetallionen entscheiden sich die Elektronen für parallelen Spin selbst dann, wenn sie die Möglichkeit zur Paarung haben — z.B. in der Mehrzahl der Fe²⁺-Salze (d⁶) haben fünf Elektronen spin-up und nur eines spin-down.

Das ist super interessant.
Ich warte noch mit der Frage zur Quantenmechanik, da ich noch nicht so weit bin und frage sonst wo weiter.
Eine Ahnung wo ich nach diesem Wissen googeln kann um selber das lesen zu können?
Wie immer danke für die nützliche Antwort :)

Irgendein Lehrbuch der anorganischen Chemie, aber das ist nichts, was man an einem Nachmittag (oder in einer Woche) durchliest. Allerdings sind diese Bücher meistens sehr schwach dabei, die quantenmechanischen Effekte wirklich zu erklären — dazu braucht man mehr Vorwissen, als vom Leser vorausgesetzt werden kann.

Jein. Es gibt ZrCl2, das wird allerdings durch Fremdatome stabilisiert. Reines ZrCl3 gibt es.

Interessant, überrascht mich das das Zr die Ladung 3+ hat, da hat es doch ein ungepaartes Elektron oder?

Die Basics mit den Oktaederlücken etc. kenne ich, braucher abr wohl ne weile bis ich mehr verstehe. Trotzdem danke! Das Buch werde ich mir anschauen.