Bedeutung einer Kurvenverlauf von ph = -log[c(H3O+)] und pOH = -log[c(OH-)]?
Hallo,
Ich verstehe Mathematisch nicht was mir der negative dekatischer logarithmus mir beim ph und poh sagt wieso verläuft dan die kurve negativ exponential nach unten bei ph und poh ? Nehmen die konzentration negativ ab ? Was verändert sich da ? Kann man mir vielleicht einen Kurvenverlauf zeichnen und es so erklären wäre toll :)
1 Antwort
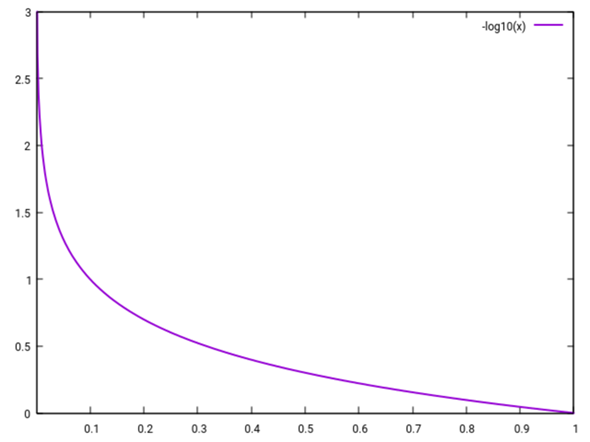
Das sieht nicht besonders spektakulär aus — wenn c(H₃O⁺) sehr klein ist, dann steigt pH merklich an. In den steilen Bereich hineinzuzoomen bringt nicht viel, weil die Form der Kurve skaleninvariant ist:
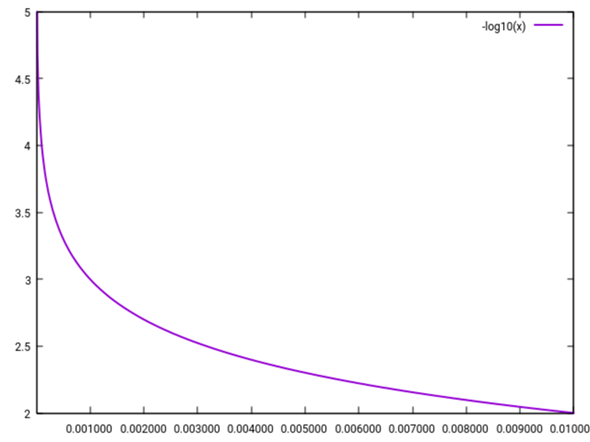
Ich verstehe nicht. Negative x-Werte sind wegen der Logarithmus-Funktion nicht erlaubt und auch nicht physikalisch sinnvoll, weil Konzentrationen selten negativ werden. Es gilt aber lim (x→0) f(x) = ∞, was in der Praxis nie auftreten kann weil durch die Autoprotolyse des Wassers immer garantiert ist, daß zumindest ein paar OH⁻ und H₃O⁺ in der Lösung herumschwimmen, also immer x>0.
Da wäre noch eine kurtze frage würde die funktion mathematisch nicht limx gegen -∞ f(x) = ∞ lauten ?