Gleichgewichtskonstant?
Bei der Gleichgewichtsreaktion Alkohol + Säure
bei äquimolarem Einsatz von Alkohol und Säure auf
Ester + Wasser beträgt der Umsatz bei 80 °C genau 70%.
a) Wie groß ist die Gleichgewichtskonstante K?
b) Der Umsatz soll bei gleicher Temperatur auf 95% gesteigert werden. Wie viele Mole Alkohol müssen Sie pro mol Säure einsetzen?
2 Antworten
Säure + Alkohol ⟶ Ester + Wasser
Der Umsatz soll unter irgendwelchen Bedingungen 70% betragen, wenn man die beiden Edukte äquimolar mischt, aus einem Mol Edukt werden also 0.7 mol Produkt, und 0.3 mol Edukt bleiben übrig. Das setzen wir ins Massenwirkungsgesetz ein und rechnen es einfach aus:

Dabei habe ich das MWG ausnahmesweise direkt mit Stoffmengen, nicht Konzentrationen formuliert. Das kann ich in diesem Fall machen, weil sich die Teilchenzahl nicht ändert.
In der zweiten Frage soll berechnet werden, wieviel Alkohol man braucht, um die Ausbeute (bezogen auf die Carbonsäure) auf η=95% zu steigern.
- Nenne den gefragten Überschuß r, also n₀(Alkohol)=r⋅n₀(Säure). Die tiefgestellte Null zeigt dabei an, daß das Einwaagemengen sind, nicht die Mengen im Gleichgewicht. Nennen wir die Einwaagemenge an Säure einfacherweise n₀.
- Im Gleichgewicht sollen η=95% der Säure zu Ester und Wasser reagiert haben, also n(Ester)=n(Wasser)=ηn₀.
- Umgekehrt bleiben im Gleichgewicht 5% der Carbonsäure übrig, also n(Säure)=(1−η)n₀.
- Zuletzt stellt sich die Frage nach dem Alkohol. Wir beginnen mit der Stoffmenge rn₀, und 95% von n₀ reagieren, also bleiben rn₀−ηn₀=(r−η)n₀ übrig.
Also kennen wir alle vier Gleichgewichtskonzentrationen. Wir können nun ins Massenwirkungsgesetz gehen und nach r auflösen:

Damit haben wir also die Antwort: Wir brauchen den 4.27-fachen Ethanolüberschuß.
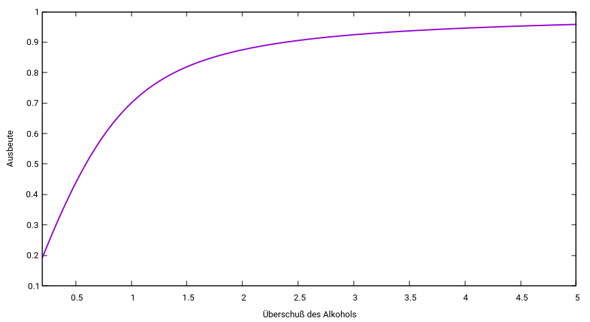
Wir können aber noch eine kleine Fleißaufgabe machen: Dazu lösen wir uns das Massenwirkungsgesetz nicht nach r, sondern nach η auf. Dann erhalten wir eine quadratische Gleichung, und deren Lösung gibt an, wie die Ausbeute mit der eingesetzten Alkoholmenge zusammenhängt. Sinnvollerweise plotten wir das dann:


Man sieht, daß in diesem die Ausbeutesteigerung zemlich moderat bleibt. Von den 75% bei r=1 (äquimolar) geht es nur langsam bergauf, zu 95% bei r=4.27. Man verschwendet also ziemlich viel Alkohol für ziemlich wenig Estergewinn.
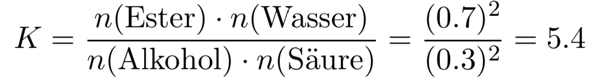
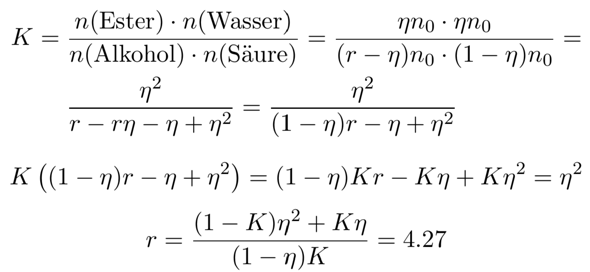
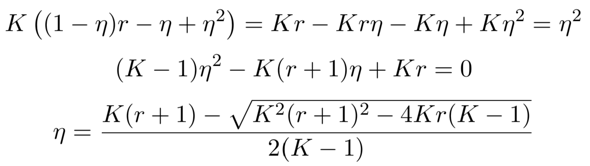
a) K = 70 * 70/(30 * 30) = 5,44
b) 1
Was ist für b) geschrieben habe, ist wegen meiner Verständnisprobleme beim Lesen der Aufgabe natürlich Müll. Daher noch einmal ganz langsam.
Da es hier um relative Konzentrations- bzw. Stoffmengenverhältnisse geht, setze ich den Ausgangswert für die Carbonsäure einfach gleich 1.
c(S0) = 1
Die Einheiten können wir schlabbern, da sich diese ohnehin rauskürzen.
Die Säure reagiert zu 95 % zum Ester und zu Wasser. Damit gilt am Gleichgewichtspunkt:
c(E) = c(H2O) = 0,95
Übrig bleibt am Gleichgewicht also der unreagierte Anteil der Carbonsäure:
c(S) = c(S0) - 0,95 = 0,05
Die Alkoholkonzentration am Gleichgewicht nenne ich x. Dann ergibt sich für das Massenwirkungsgesetz:
5,44 = 0,95 * 0,95/(0,05 * x)
x = 3,34
0,95 vom Alkohol sind nach der Reaktion im Ester gebunden, sodass die Ausgangskonzentration des Alkohols
c(A0) = 3,34 + 0,95 = 4,29
betragen muss.
Bezogen auf 1 für die Carbonsäure ist das ein Überschussverhältnis von 4,29.