Zusammenhang zwischen oxidationszahl, teilladung und Elektronegativität?
ich lerne gerade wie man oxidationszahlen bestimmt und verstehe nicht, was oxidationszahlen mit der teilladung eines Atoms zu tun hat und welche Rolle die EN spielt
1 Antwort
Moin,
der Zusammenhang ist folgender:
In Atombindungen (Elektronenpaarbindungen) sind zwei Atome miteinander verbunden. Es gibt also keine Ionen. Aber wenn nicht gerade zwei gleiche Atome miteinander verbunden sind, haben die miteinander verbundenen Atome unterschiedliche Elektronegativitätswerte. Das kann dazu führen, dass polare Atombindungen entstehen, in denen der elektronegativere Bindungspartner eine negative Partialladung (Teilladung) hat, weil er das bindende Elektronenpaar stärker zu sich heran zieht.
Der weniger stark elektronegative Bindungspartner hat dann eine positive Partialladung (Teilladung), weil das bindende Elektronenpaar von ihm weggezogen wird.
Aber egal, wie groß der Unterschied in den Elektronegativitätswerten ist, auf jeden Fall wird bei der Ermittlung von Oxidationszahlen dem elektronegativeren Bindungspartner ein bindendes Elektronenpaar vollständig zugesprochen.
Nur wenn zwei gleiche Atome miteinander verbunden sind, wird das bindende Elektronenpaar geteilt und jedem Bindungspartner wird ein Elektron zugeteilt.
Am Ende (nachdem alle bindenden Elektronenpaare zugeteilt worden sind) vergleicht man die Anzahl der zugeteilten Elektronen mit der Anzahl, die das betreffende Atom ohne Bindungspartner hätte, und dann sieht man, ob das Atom mehr, gleich viele oder weniger Elektronen als im ungebundenen Zustand hat. Dementsprechend ergibt sich dann die Oxidationszahl.
Machen wir das an einem Beispiel klar:
Propansäure hat folgende Struktur:
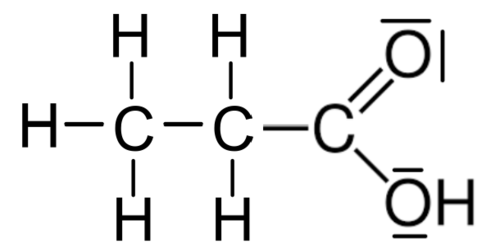
Wasserstoff hat eine Elektronegativität (EN) von 2,2. Die EN von Kohlenstoff beträgt 2,5 und die von Sauerstoff 3,5.
Dementsprechend werden alle H-Bindungen dem jeweils elektronegativeren Bindungspartner C oder O zugeteilt.
Die C–C-Bindungen werden jeweils geteilt, weil beide Bindungspartner natürlich exakt die gleiche EN haben.
Die Bindungen zwischen C und O werden dem Sauerstoff zugeteilt, weil er der elektronegativere Bindungspartner ist.
Dann haben alle H-Atome nach der Zuteilung kein Elektron mehr. Da Wasserstoffatome aber im ungebundenen Atom über ein Valenzelektron verfügen, ist das formal so, als hätten die gebundenen Wasserstoffatome alle ein Elektron abgegeben. Darum haben sie alle die Oxidationszahl +I.
Dem Kohlenstoffatom links in der Abbildung werden insgesamt sieben Elektronen zugeteilt (drei Paare aus den Bindungen zu den Wasserstoffatomen plus ein einzelnes Elektron aus der C–C-Bindung; das macht 3 • 2 + 1 = 7 Elektronen).
Ein ungebundenes Kohlenstoffatom hat vier Valenzelektronen. Es ist hier also so, als hätte dieses C-Atom drei Elektronen aufgenommen. Deshalb lautet seine Oxidationszahl –III.
Das mittlere C-Atom erhält sechs Elektronen zugeteilt (zwei Paare aus den Bindungen zu den Wasserstoffatomen plus zweimal ein Elektron aus den beiden Bindungen zu den anderen C-Atomen; macht zusammen 2 • 2 + 1 + 1 = 6 Elektronen). Darum hat dieses C-Atom die Oxidationszahl –II.
Das rechte C-Atom hat nach der Zuteilung nur noch ein Elektron, denn alle Bindungen zu den Sauerstoffatomen werden dem elektronegativeren Sauerstoff zugeteilt, so dass nur noch ein Elektron aus der C–C-Bindung dem rechten C-Atom gehört. Das sind im Vergleich mit einem ungebundenen C-Atom drei Elektronen weniger. Deshalb lautet die Oxidationszahl von diesem C-Atom +III.
Die Sauerstoffatome haben beide die Oxidationszahl –II, denn ihnen werden sämtliche Elektronenpaarbindungen vollständig zugesprochen. Dadurch haben sie zusammen mit ihren beiden freien, nicht-bindenden Elektronenpaaren insgesamt acht Valenzelektronen, also zwei mehr als im ungebundenen Zustand.
Du kannst das auch noch überprüfen. Das Molekül hat keine Ladung. Deshalb muss die Summe der Oxidationszahlen aller Bindungspartner zusammen 0 (Null) ergeben, weil die Summe aller Oxidationszahlen der Ladung eines betrachteten Teilchens entspricht.
Nun denn, rechnen wir zusammen:
6 H: 6 • +I = +VI
2 O: 2 • –II = –IV
C: –III
C: –II
C: +III
+VI –IV –III –II +III = 0
und siehe da, es passt...
Alles klar?
LG von der Waterkant