Wieso ist beim Halbäquivalenzpunkt der pH-Wert gleich der pkS-Wert?
Bei einer schwachen Säure und einer starken Base, könnte mir das vielleicht einer, der das begriffen hat verständlich darlegen?
3 Antworten

Moin,
der Halbäquivalenzpunkt bei einer Säure-Base-Titration einer mittelstarken bis schwachen Säure liegt doch dort, wo die Hälfte einer bestimmten Stoffmenge Säure mit der entsprechenden Stoffmenge an Base neutralisiert hat.
An diesem Punkt gilt [HA] = [Ac^–]. Das gilt, weil zum Beispiel bei einer schwachen Säure die meisten Säuremoleküle undissoziiert vorliegen. Wenn ich aber immer mehr Base hinzu titriere, dann „zwingen” die Base-Teilchen die bis dahin undissoziierten Säuremoleküle dazu, Protonen abzuspalten. Dann kommt logischerweise irgendwann ein Punkt, bei dem von meiner Ausgangsmenge Säure genau die Hälfte dissoziiert vorliegt.
Für schwache Säuren gilt aber entweder
pH = pKs –lg([HA]/[A^–])
oder
pH = pKs +lg([A^–]/[HA])
Aber egal, welche Form der sogenannten Henderson-Hasselbalch-Gleichung du nimmst, der Ausdruck –lg([HA]/[A^–]) oder +lg([A^–]/[HA]) ist für den Fall [HA] = [A^–] (also am Halbäquivalenzpunkt) gleich Null. Und so kommt es, dass am Halbäquivalenzpunkt der pH-Wert = dem pKs-Wert der Säure ist, weil es egal ist, ob du zu diesem pKs-Wert Null addierst oder davon subtrahierst.
Darum gilt am Halbäquivalenzpunkt pH = pKs.
LG von der Waterkant

Die erste Frage ist wohl: Ist der pH-Wert wirklich gleich dem pKₐ genau halb zwischen den Äquivalenzpunkten? Um das zu erstehen, zeige ich Dir hier eine Titrationskurve von 1 ml/l Oxalsäure mit 1 mol/l Natronlauge:
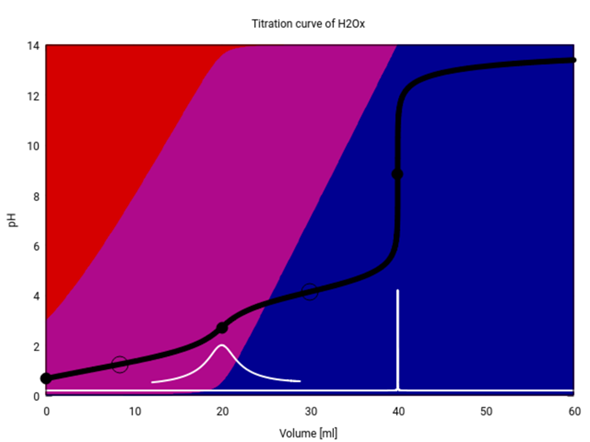
Die schwarze Kurve ist die Titrationskurve, die weiße ist die erste Ableitung davon (man sieht die Wendepunkte als Maxima). Der Hintergrund codiert die Oxalat-Spezies: Rot ist die Oxalsäure (zweibasig, also H₂Ox), violett ist das Hydrogenoxalat HOx⁻ und blau ist das Oxalat Ox²⁻. Die schwarzen Punkte auf der Titrationskurve markieren die Äquivalenzpunkte: Bei V=0 ml hat man nominal reine Oxalsäure, bei 20 ml reines Hydrogenoxalat, und bei 40 ml reines Oxalat.
Die schwarzen Kreise markieren die Punkte, bei denen pH=pKₐ gilt, also die Halbäquivalenzpunkte. Du siehst, daß einer bei 30 ml liegt, also dort wo man es erwartet. Der andere liegt dagegen nicht bei den erwarteten 10 ml, sondern bei 8.4 ml. Der Grund dafür wird klar, wenn man sich das Massenwirkungsgesetz ansieht:
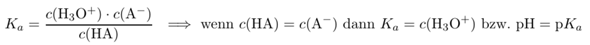
Wenn HA eine schwache Säure ist, dann liegt sie am Anfang der Titration überwiegend als HA vor, also undissoziert, am Ende aber überwiegend als Anion A⁻. Zwangsläufig muß irgendwann während der Titration c(HA)=c(A⁻) erreicht werden, und dann folgt ebenso klar aus dem MWG, daß dann pH=pKₐ gelten muß.
Aber an welchem Punkt der Titration gilt c(HA)=c(A⁻)? Nun, wenn alle Säure- und Basespezies schwach sind, dann erwartet man diese Punkte genau auf halbem Weg zwischen den Äquivalenzpunkten: An einem Äquivalenzpunkt sollte ja eine Spezies zu fast 100% vorliegen, und beim nächsten eine andere, also sollte es am Punkt dazwischen genau 50:50 stehen.
Bei der gezeigten Kurve ist das aber nur bei V=30 ml so, weil Hydrogenoxalat wirklich eine hinreichend schwache Säure und Oxalat eine hinreichend schwache Base ist. Oxalsäure selbt ist aber keine schwache sondern eine mittelstarke Säure (Du siehst ja, daß sie bei V=0 ml bereits zu ca. ⅕ dissoziiert ist), daher rutscht der Punkt, an dem pH=pKₐ gilt, zu niedrigerem Verbrauch als die erwarteten 10 ml.
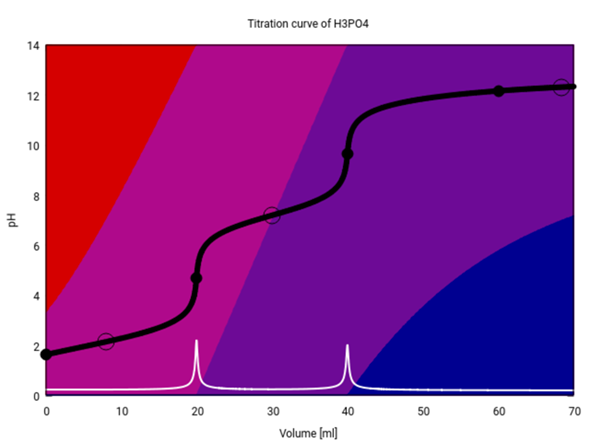
Ganz deutlich sieht man das auch mit der Titration von H₃PO₄ mit 0.1 mol/l NaOH:
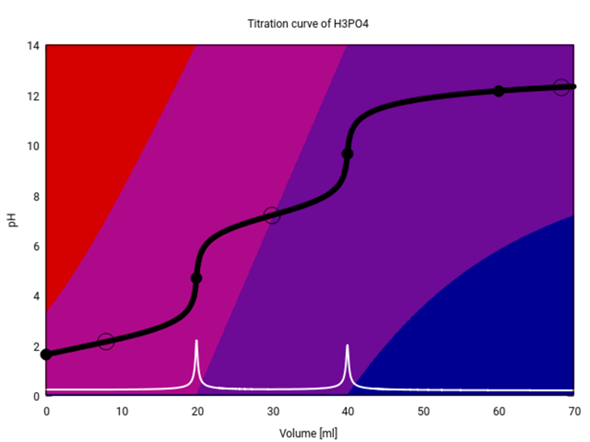
Hier haben wir vier verschiedene Spezies: Rot die H₃PO₄, rotviolett H₂PO₄⁻, blauviolett HPO₄²⁻ und blau PO₄³⁻. Die drei Punkte mit pH=pKₐ liegen bei 8 ml, 30 ml und 68.4 ml (zu erwarten wären 10, 30 und 50 ml). Der erste Punkt ist leicht verschoben, weil Phosphorsäure ähnich stark wie Oxalsäure ist, und der dreitte ist drastisch verschoben, weil PO₄³⁻ eine ziemlich starke Base ist und niemals vollständig vorliegt.
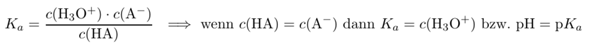


Rein rechnerisch würde ich sagen, das folgt aus der Henderson-HasselbaLch Gleichung