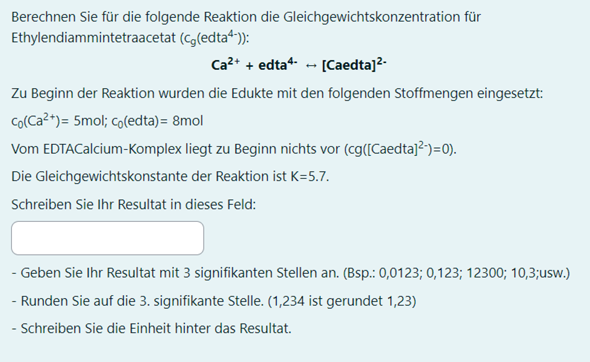
Wie muss ich dies Lösen, am besten mit Lösungsweg?
1 Antwort

Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Formel, Chemie, Naturwissenschaften
Das läßt mit die Haare zu Bergen stehen
c₀(Ca²⁺)=5 mol; c₀(edta)=8 mol; K=5.7
Da stimmt ja nichts.
- Konzentrationen gibt man in mol/l an, nicht in mol. Es sind ja keine Stoffmengen, sondern Stoffmengen pro Volumen.
- Wenn ich annehme, daß die Einheit falsch ist und c₀(Ca²⁺)=5 mol/l etc gemeint ist, dann sind diese Konzentrationen absurd hoch. Da müßte man ja mehr al 1 kg EDTA in einen Liter Lösung bringen.
- Dieses Datenblatt sagt, daß sich vom EDTA-Dinatriumsalz nur 0.26 mol in einem Liter Wasser lösen.
- Wenn es vielleicht als mmol/l gemeint ist, dann würde es Sinn ergeben, aber dann landen wir beim nächsten Problem:
- Die Gleichgewichtskonstante sollte eine Einheit haben, und wenn wir die nicht kennen und auch nicht wissen, welche Einheiten die Konzentrationen haben, dann sind wir ge-eff-t.

indiachinacook
28.11.2023, 18:56
@Igweissdatnit
Nein, bei der Gleichgewichtskonstanten dividierst Du eine Konzentration durch zwei Konzentrationen, also kommt eine reziproke Konzentration heraus (l/mol). Ich weigere mich zu glauben, daß man die Konzentrationen als 5 mol/l bzw. 8 mol/l lesen soll (und falls doch, dann ist der, der die Aufgabe zusammengestellt hat, ein kapitaler Wappler), und zusammen mit der unklaren Gleichgewichtskonstante wird das das reinste Ratespiel.
Falls das wirklich alles ernstgemeint ist, dann setzt Du c(Ca(edta)²¯)=x, c(edta⁴¯)=c₀(edta⁴¯)−x und c(Ca²⁺)=c₀(Ca²⁺)−x an, setzt ins Massenwirkungsgesetz ein und löst nach x. Aber mit der Realität hat das gar nichts zu tun.
Das ist eine Aufgabe in unserem Pretest für die nächste Prüfung also müsste es irgendwie doch stimmen, weil Gleichgewichtskonstante ist doch mol/l durch mol/l?