Warum sind diese Strukturen in Lauge löslich?
Hallo an euch!
Ich kann mir irgendwie nicht erklären warum diese Strukturen in Lauge löslich sind. Die einzige Gemeinsamkeit die ich in allen (außer in pic 4) sehe ist, dass sie eine Carbonsäureamid Struktur haben, die ja neutral ist. Also sollte sich weder in Säure noch in Lauge ''was tun''. Und beim 4. Bild habe ich überhaupt keine Ahnung, warum es in Lauge löslich ist.
Danke schonmal für Tipps und Antworten.
LG
4 Antworten
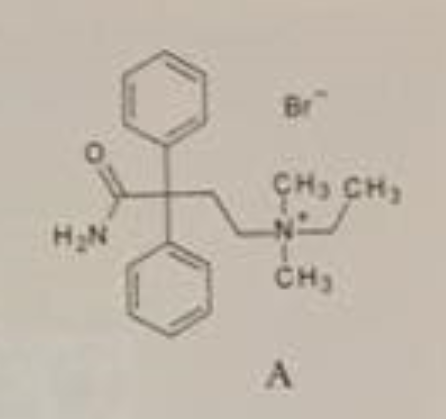
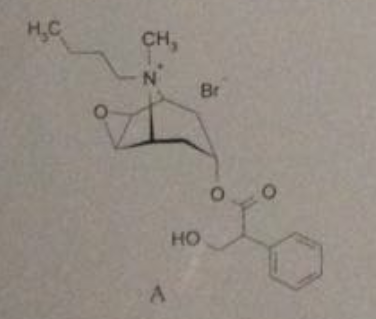
1 und 4 sind quarternäre Ammoniumsalze des Typs (R1,R2,R3,R4)N⁺ X⁻. Diese sind sehr gut wasserlöslich und bilden mit Alkali die entsprechenden Hydroxide (R1,R2,R3,R4)N⁺ OH⁻.
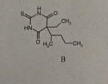
Bei Verbindung 2 handelt es sich um ein Derivat der Barbitursäure, pKs = 4,0. Hier sind die Amid-H durch den Elektronenzug von 3 C=O-Gruppen schon ziemlich azide. Es handelt sich hier um das Thiobarbiturat Thiopental.
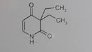
Ähnlich sind die Verhältnisse bei Verbindung 3. Auch hier ziehen 2 Carbonyl-C am Amid-N, wobei eine Carbonylfunktion das über eine konjugierte Doppelbindung erledigt. Das Amid-H wird auch hier ziemlich azide.
Die Verhältnisse sind ähnlich denen beim Phthalimid, wobei die Imidgruppe ebenfalls sauer reagiert (pKa = 8,3) und sich leicht mit alkoholischer KOH zum Kaliumphthalimid umsetzen lässt.
Ich hätte noch ein letztes Beispiel als Antwort angefügt, wäre super, wenn Du dir anschaust ob meine Begründung plausibel/richtig ist :)
Numer 2 und 3 kann ich leider nicht ausreichend erkennen - aber bei 1 und 4 dürfte sich die positive Ladung im Umfeld von vielen Hydroxid-Ionen recht wohl fühlen...
An Picus48 noch: Also in meinen Lösungen steht, dass diese Verbindung NICHT in Lauge aber dafür in Säure löslich ist. Ist hier der Grund, dass keine elektronegativen Atome in der Nähe sind, die dem H des NH eine positive Partialladung geben, sodass es nicht vom OH- sondern vom H+ der Säure ''angezogen'' wird?
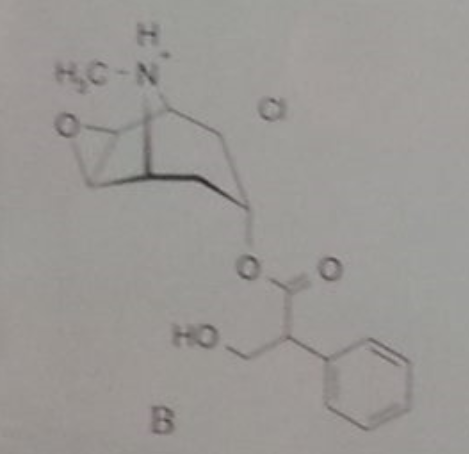
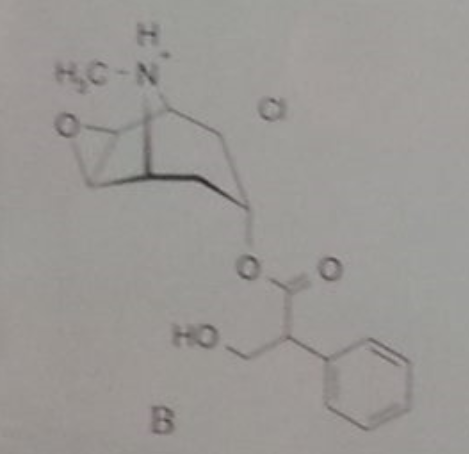
Hier handelt es sich doch einfach nur um ein gewöhnliches tertiäres Amin des Typs R1,R2,R3-N, wobei die 3 Alkylreste aufgrund ihres +I-Effektes die Elektronendichte am N eher vergrößern und den Stickstoff basischer machen. Und Amine sind nun mal als Ammoniumsalze [R1,R2,R3-N⁺-H X⁻] in Säuren löslich.
passt so, quartärnäre Amine sind prinzipiell in wässrigen oder wasserähnlichen Phasen löslich (war ein Teil meines Org. Grundpraktikums)
..... in Säure würdest du ja protonieren !!!!!! und der Löslichkeit entgegenwirken....
Also sind quartäre Amine in Laugen löslich, und tertiäre in Säuren???
Weil ein Quad eben kein freies Amin ist, denn hier wird das (basische) freie Elektronenpaar zur Ausbildung einer kovalenten Bindung zu einem 4. Bindungspartner verwendet. Das ist dann nicht mehr basisch. Und dass sich ein Kation in einer alkalischen Umgebung wohlfühlt, hatte ja schon Bavarian gepostet. Beim Ammonium-Ion kommt die positive Ladung ja erst nach der Reaktion mit der Säure in Form eines Protons auf das Amin-N. https://de.wikipedia.org/wiki/Quart%C3%A4re_Ammoniumverbindungen
Ich verstehe die Verwirrung schon. Man muss sich halt darüber klar werden, dass ein Quad chemisch etwas anderes ist als das Salz eines Amins (Ammoniumsalz).
Also ich habe hier die zwei Bilder noch mal vergrößert :) Ich hoffe, man kanns erkennen.
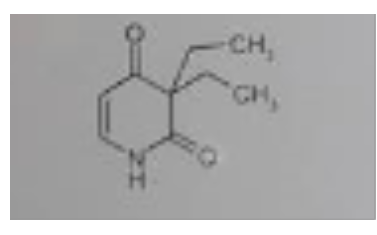
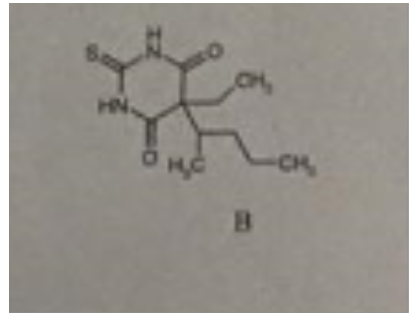
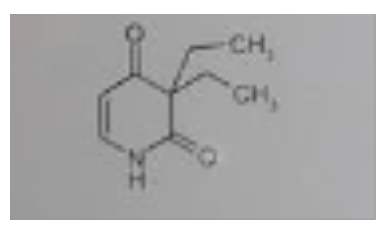
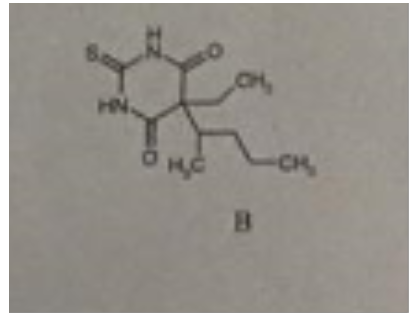
der Wasserstoff am N ist im cyclischen Amid partiell positiv geladen und kann daher durch starke OH- Ionen Konzentration "abgespalten" werde, worauf dann eine gewisse Löslichkeit beruht
Ich habe die zwei Bilder nochmal als Antwort hinzugefügt. Diese Strukturen besitzen aber keine Ladung :/ Sie sind trotzdem löslich in Lauge.