Warum hat Ammoniak einen höheren Siedepunkt als Phosphan und die anderen?
Auf der Grafik sieht man dass NH3 einen deutlich höheren Siedepunkt hat als PH3. Woran liegt das? Kann mit das jemand verständlich erklären?
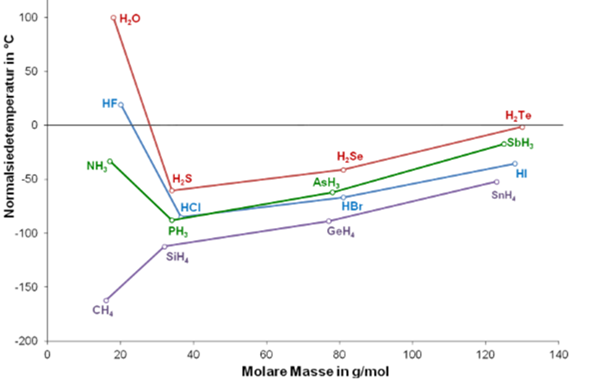
Vielen dank für eure Hilfe!!!
2 Antworten
Die starke Polarität des Ammoniakmoleküls (1,5 D [= Debye]) ist der Grund für dessen höhere Siedetemperatur im Vergleich zum Phosphorwasserstoff (0,6 D). Diese Polarität bedingt die Wasserstoffbrückenbindungen zwischen den Molekülen. Da das Phosphoratom größer ist als das Stickstoffatom nimmt die Polarität und damit die Stärke der Wasserstoffbrückenbindung ab. Die Phosphorwasserstoffmoleküle ziehen sich gegenseitig weniger stark an als die Ammoniakmoleküle.
Dass übrigens die Wasserstoffverbindungen der Elemente aus der 5. Hauptgruppe wieder ansteigende Siedetemperaturen haben, zeigt, dass nicht nur Wasserstoffbrücken für die Siedetemperatur verantwortlich sind.
höherer Siedepunkt -> höhere Anziehungskräfte zwischen den Molekülen -> sogn. Wasserstoffbrückenbindungen zwischen den positivierten WasserstoffAtomen und dem freien Elektronenpaar des Stickstoffs.
Diese Wechselwirkung ist stärker, als die Van der WaalsKräfte, die bei den schwereren Molekülen wirksam sind.
WasserstoffBrücken gibt es nur in Kombination von H-F, O-H und N-H
Wie ist das dann bei GeH4 und HCl. Ist das das selbe??